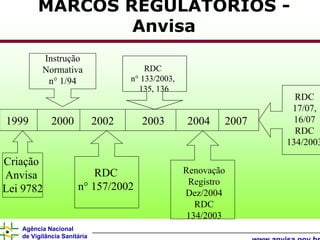
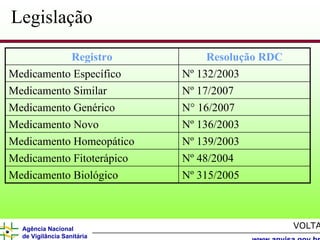
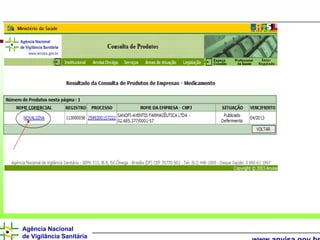
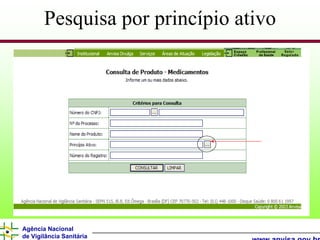
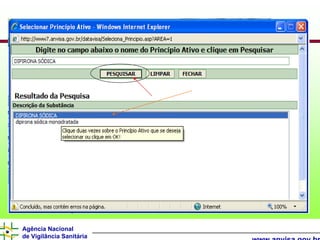
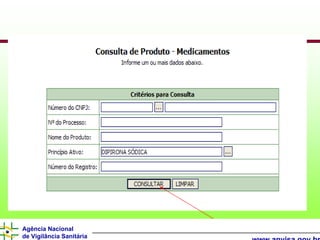
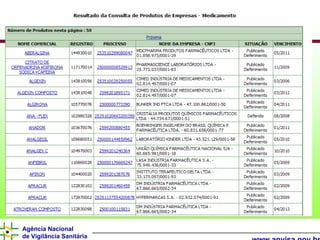
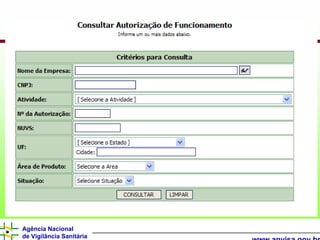
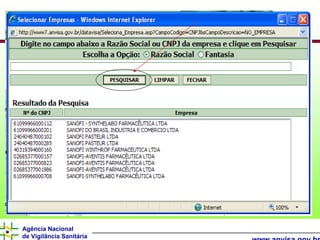
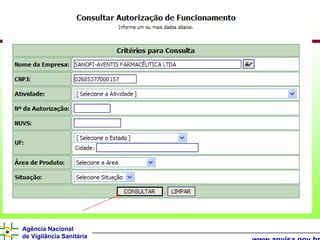
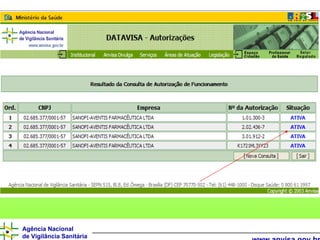
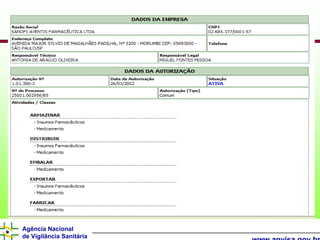
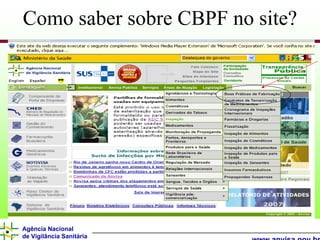
O documento descreve os processos e requisitos regulatórios para registro de medicamentos na Agência Nacional de Vigilância Sanitária (Anvisa), incluindo a necessidade de registro para comercialização, tipos de medicamentos como novos, similares e fitoterápicos, e processos pós-registro.