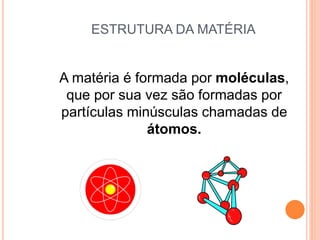
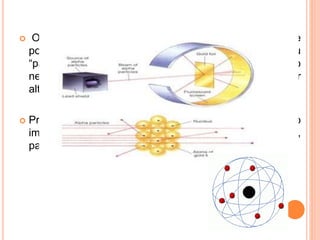
O documento discute os modelos atômicos ao longo da história, começando pelos modelos de Demócrito e Dalton que propuseram a existência de átomos indivisíveis. Posteriormente, os modelos de Thomson, Rutherford e Bohr tentaram explicar a estrutura do átomo com base em experimentos, propondo que o átomo consiste de um núcleo positivo rodeado por elétrons.