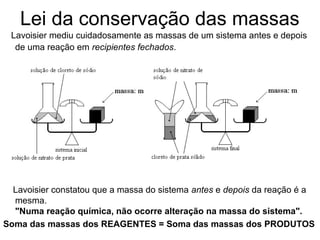
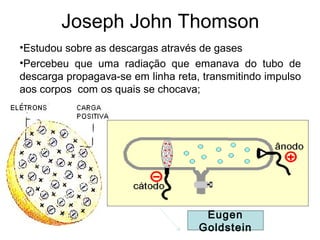
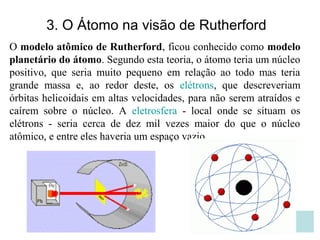
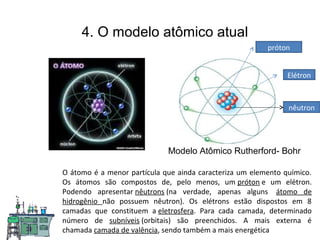
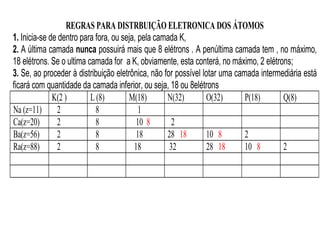
O documento discute as principais teorias atômicas ao longo da história, começando com as primeiras ideias de Demócrito e Aristóteles sobre a composição da matéria. Posteriormente, aborda as teorias de Dalton, Thomson e Rutherford sobre a estrutura do átomo, culminando no modelo atômico atual.