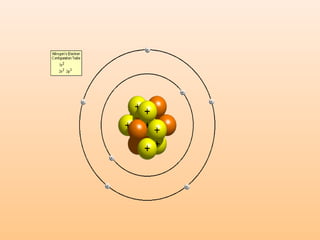
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando com a ideia de Dalton de que a matéria é formada por átomos indivisíveis. Posteriormente, os modelos de Thomson, Rutherford e Bohr tentaram explicar melhor a estrutura do átomo com base em novos experimentos, propondo respectivamente que o átomo é formado por cargas positivas e eletrônicas distribuídas uniformemente, que possui um núcleo central com cargas positivas e eletrônicas orbitando e que os eletrô