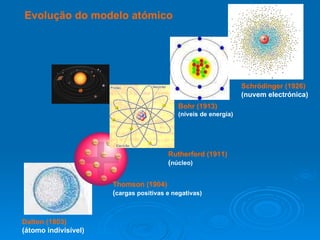
1) O documento descreve a evolução do modelo atômico desde a Grécia Antiga até o modelo atômico moderno;
2) Inicialmente, Demócrito e Leucipo propuseram que a matéria era composta por pequenas partículas indivisíveis chamadas átomos;
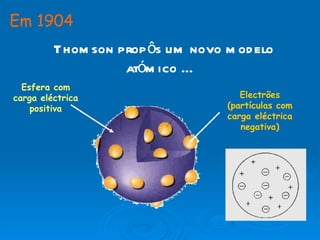
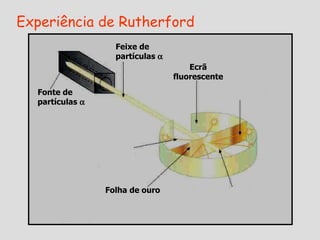
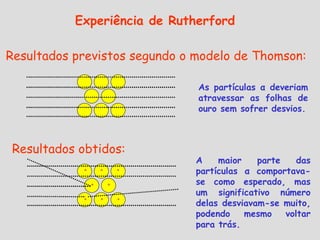
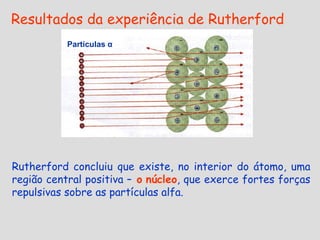
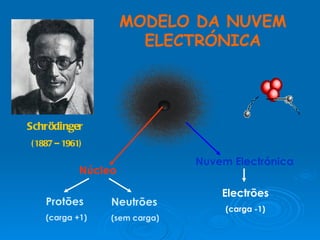
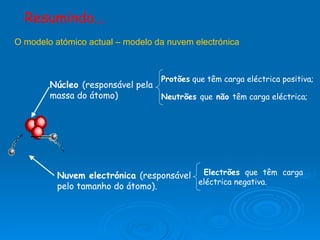
3) Experimentos posteriores levaram a modelos onde o átomo passou a ser entendido como tendo um núcleo positivo com elétrons em órbitas.