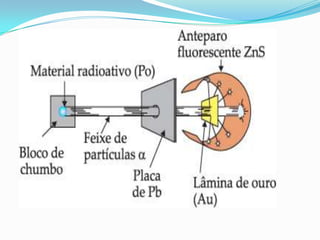
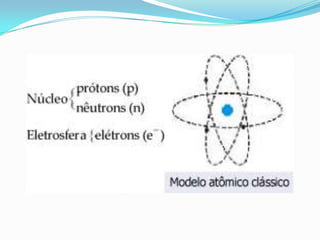
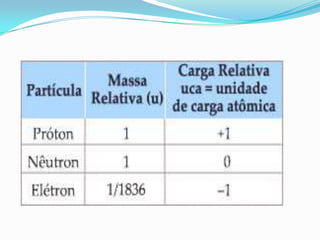
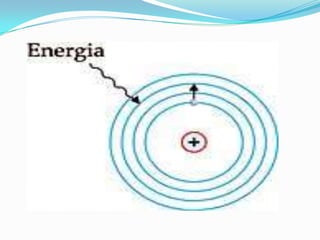
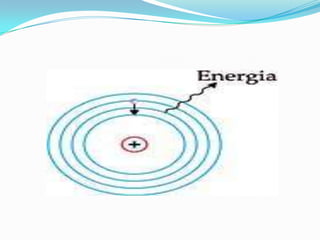
O documento descreve os principais modelos atômicos desde a Antiguidade até o modelo atômico de Rutherford-Bohr, incluindo os modelos de Dalton, Thomson, Rutherford e o modelo atômico clássico. Os modelos evoluíram à medida que novos experimentos forneceram novas evidências sobre a estrutura do átomo.