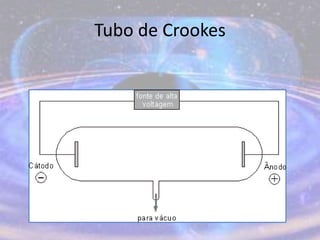
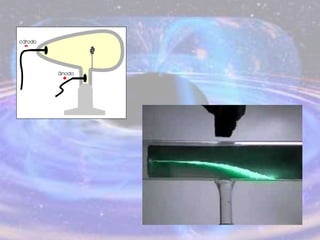
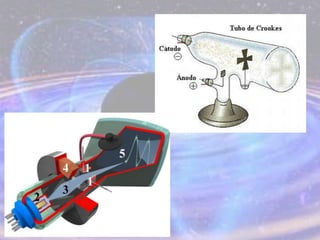
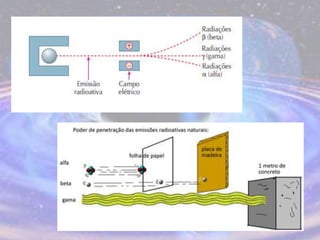
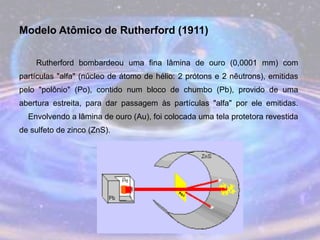
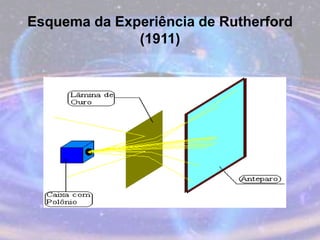
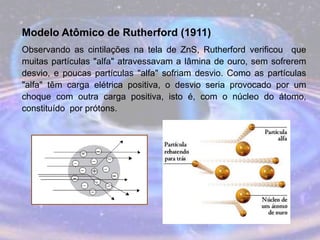
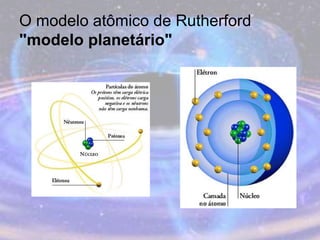
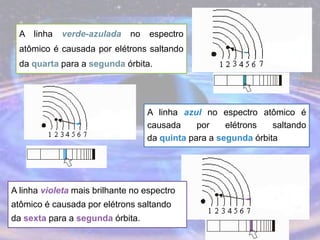
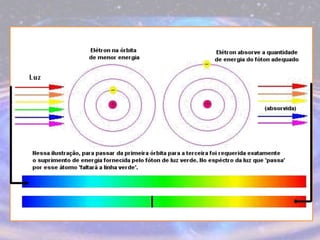
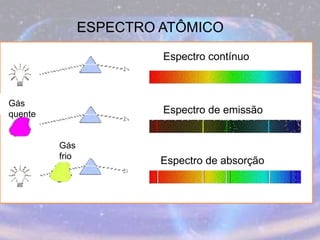
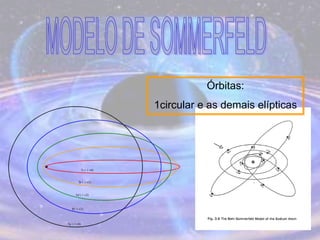
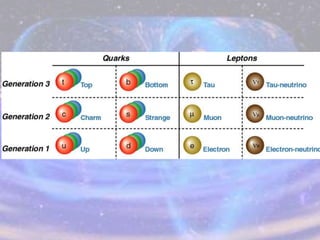
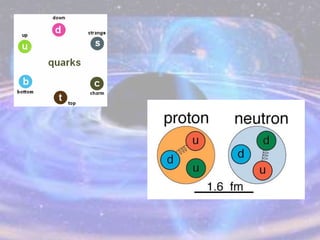
O documento descreve a evolução do modelo atômico desde os filósofos gregos até o modelo atômico atual, passando pelas contribuições de Dalton, Thomson, Rutherford, Bohr, Sommerfeld e Schrödinger. O modelo atual é probabilístico e se baseia nos princípios da dualidade onda-partícula e da incerteza de Heisenberg.