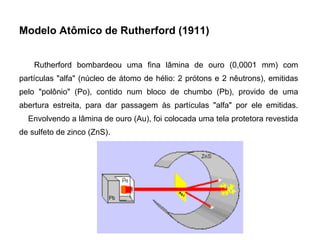
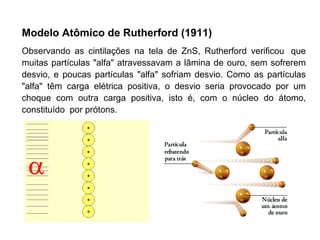
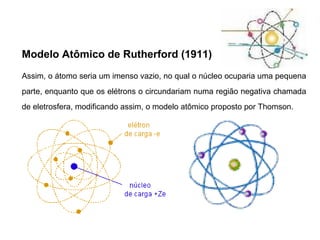
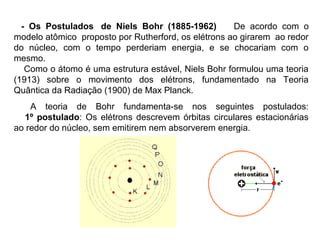
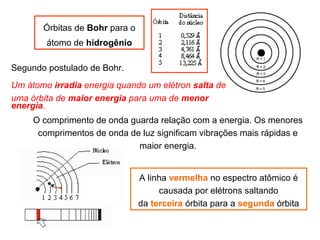
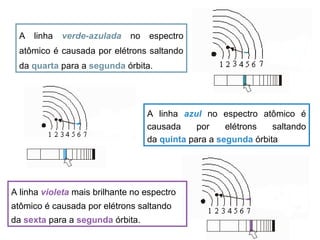
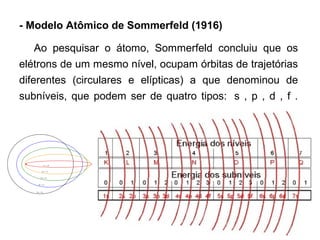
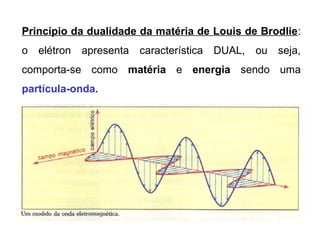
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelo modelo de Demócrito no século V a.C. que propôs a existência de átomos indivisíveis, passando pelos modelos de Thomson, Rutherford, Bohr e outros que incorporaram novos conceitos como elétrons, núcleo e mecânica quântica, até chegar à teoria da mecânica ondulatória e ao conceito de orbital eletrônico.