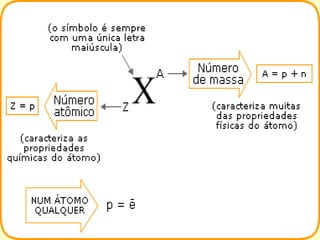
O documento descreve o modelo atômico de Rutherford e Bohr. 1) O modelo de Rutherford propôs que os átomos têm um núcleo central com prótons e nêutrons, e elétrons giram em órbitas ao redor do núcleo. 2) Bohr aperfeiçoou este modelo propondo que os elétrons só podem ocupar órbitas discretas. 3) O documento também explica conceitos como número atômico, massa atômica e isótopos.