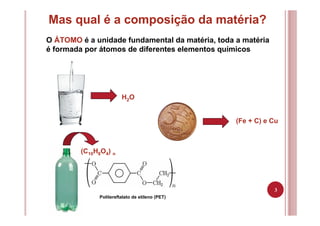
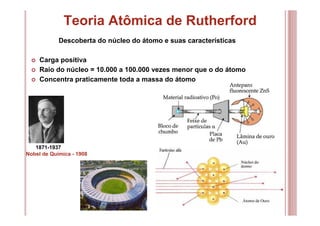
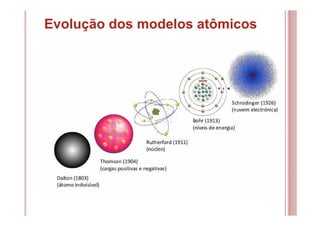
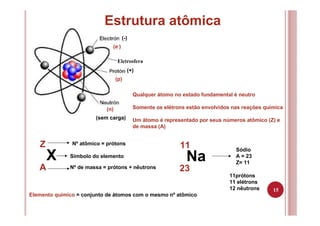
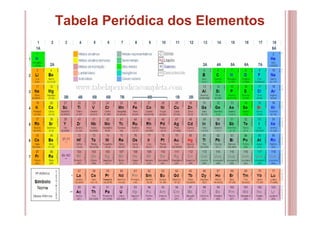
O documento discute as principais teorias atômicas ao longo da história, desde os filósofos gregos até o modelo atômico de Bohr. As teorias de Dalton, Thomson, Rutherford e Bohr representaram avanços significativos na compreensão da estrutura atômica.