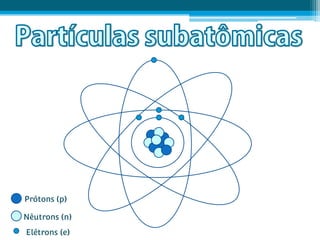
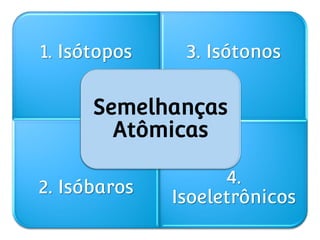
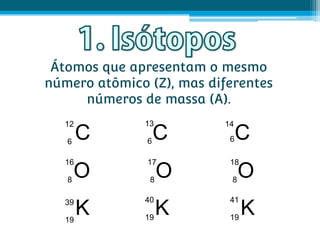
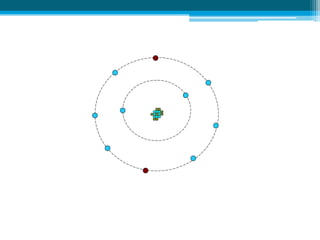
O documento apresenta conceitos fundamentais sobre a estrutura atômica, incluindo prótons, nêutrons e elétrons. Explica os termos número atômico, número de massa, isótopos, isóbaros, isótonos e isoelétrônicos. Também aborda os conceitos de átomo neutro e íons positivos e negativos.