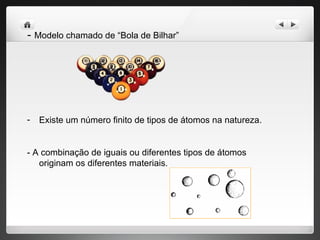
1) O documento descreve a evolução dos modelos atômicos desde a Grécia Antiga até os dias atuais, incluindo as contribuições de Demócrito, Dalton, Thomson, Rutherford e Bohr.
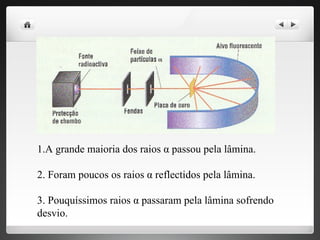
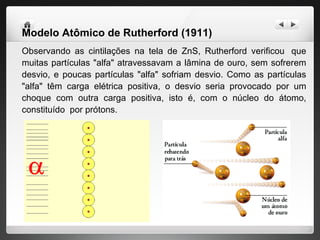
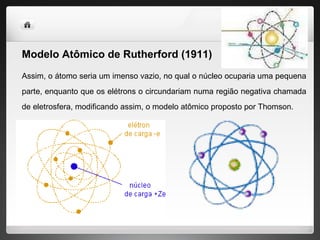
2) Rutherford propôs um modelo no qual os elétrons circulam um núcleo denso de prótons através de experimentos com partículas alfa.
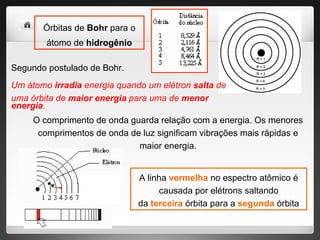
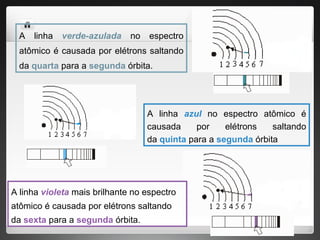
3) Bohr postulou que os elétrons só podem ocupar órbitas quantizadas e emitem ou absorvem energia ao mudar entre essas órbit