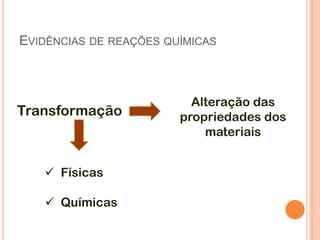
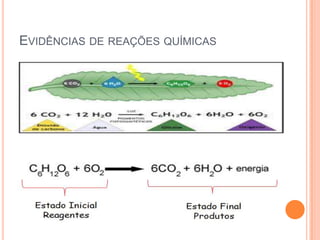
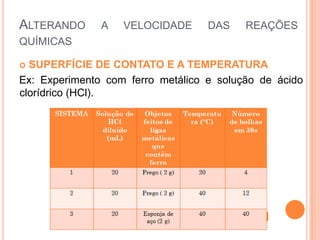
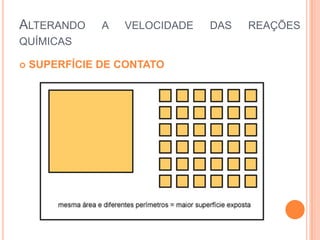
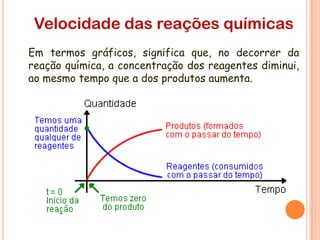
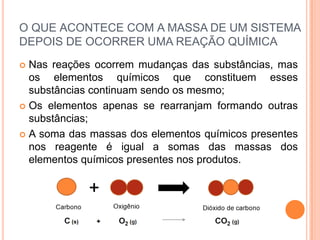
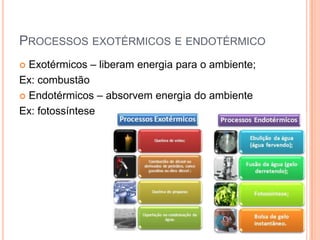
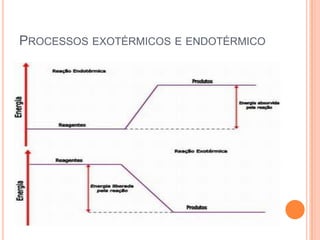
O documento discute conceitos fundamentais sobre reações químicas, incluindo evidências de reações químicas, transformações físicas versus químicas, conservação da massa, fatores que afetam a velocidade das reações, combustão, processos exotérmicos e endotérmicos, e química ambiental.