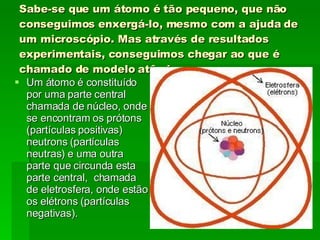
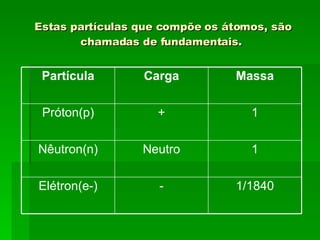
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelas ideias filosóficas de Leucipo e Demócrito no século V a.C. até chegar à teoria quântica no século XX. Destaca os principais modelos propostos por Dalton, Thomson, Rutherford e Bohr e como cada um contribuiu para o entendimento moderno da estrutura atômica.