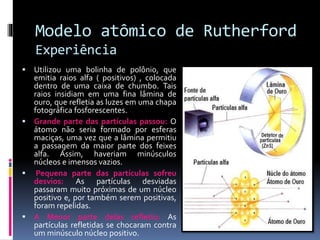
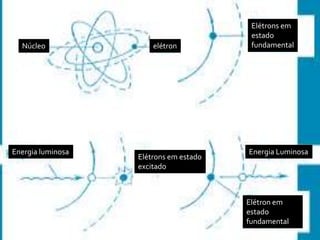
O documento descreve a evolução histórica dos modelos atômicos, desde as ideias iniciais de Demócrito e Aristóteles até o modelo atômico atual. Inclui os principais modelos de Thomson, Rutherford, Bohr e as contribuições de cientistas como Einstein, Sommerfeld e De Broglie. O modelo atômico atual vê o átomo formado por partículas positivas, neutras e negativas, com o núcleo concentrando a maior parte da massa e os elétrons situados na eletrosfera.