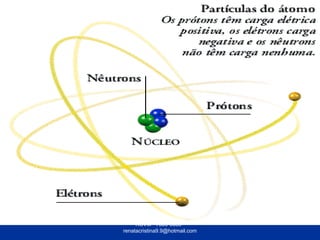
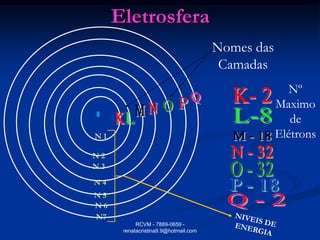
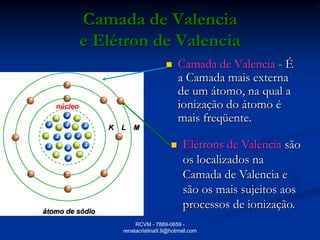
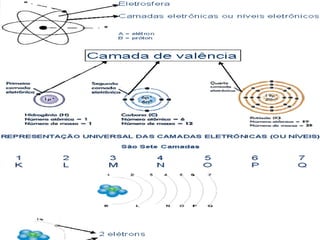
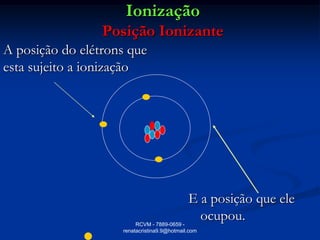
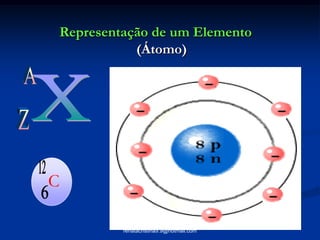
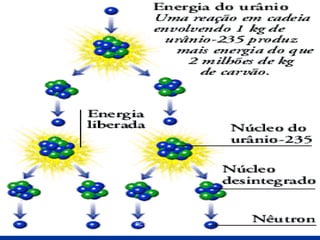
O documento fornece informações sobre átomos e suas partes constituintes. Explica que átomos são as menores partículas da matéria e são divididos em núcleo e eletrosfera. Detalha as partículas encontradas no núcleo e na eletrosfera, além de conceitos como número atômico, número de massa, íons, isótopos e reações nucleares.