Incorporar apresentação
Baixado 232 vezes



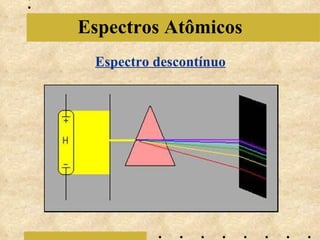


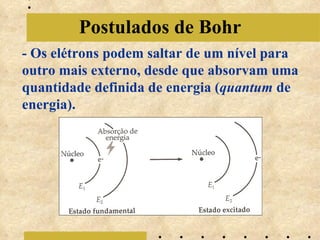

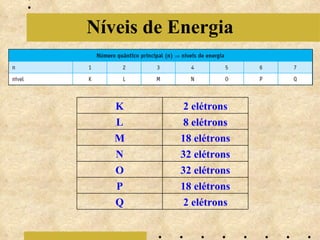
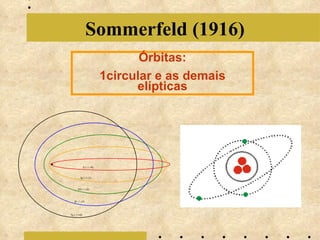





O documento descreve a evolução do modelo atômico, começando com o modelo de Bohr em 1913, que explicava a órbita dos elétrons em níveis de energia. Posteriormente, Sommerfeld admitiu que os níveis seriam formados por subníveis, enquanto Broglie propôs o princípio da dualidade onda-partícula e Heisenberg o princípio da incerteza, levando ao modelo atômico atual baseado nas equações de Schrödinger.













