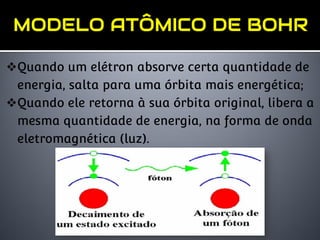
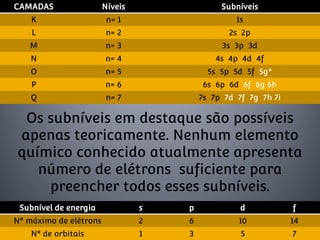
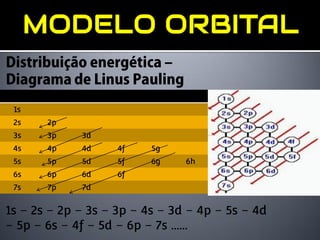
1) O documento descreve o modelo atômico de Bohr, incluindo que os elétrons descrevem órbitas circulares de energia quantizada ao redor do núcleo.
2) Foi proposto que os níveis de energia estão divididos em subníveis menores.
3) Os principais subníveis são s, p, d e f.