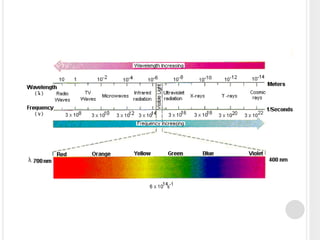
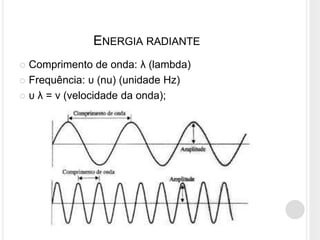
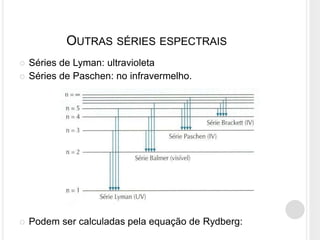
O documento discute o modelo atômico de Bohr, que propôs que os elétrons em átomos podem ter apenas certos níveis de energia quantizados. Isso explica por que os átomos não emitem energia continuamente e por que as linhas espectrais do hidrogênio aparecem em comprimentos de onda discretos. O modelo de Bohr foi capaz de prever com precisão os comprimentos de onda observados no espectro do hidrogênio.