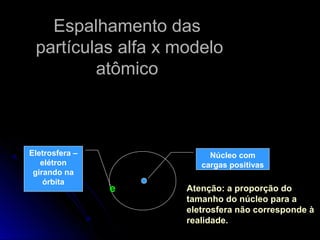
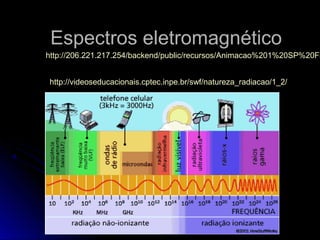
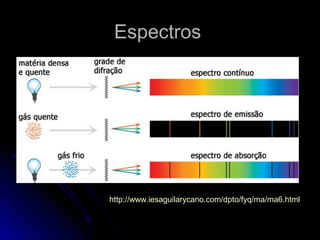
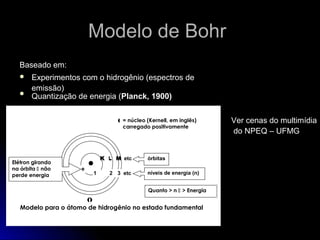
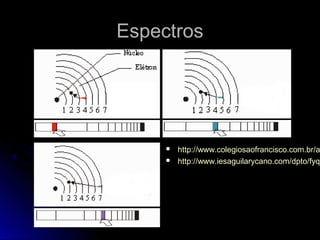
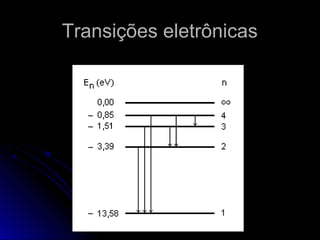
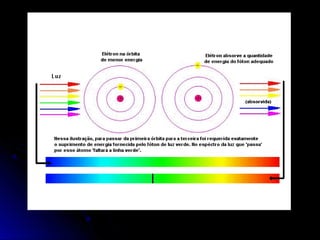
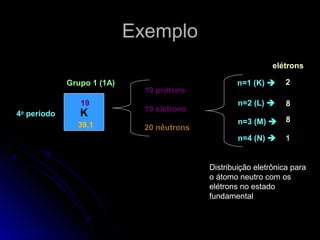
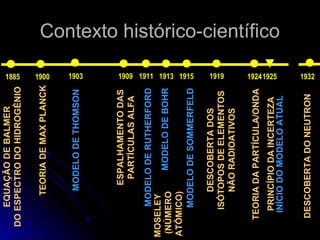
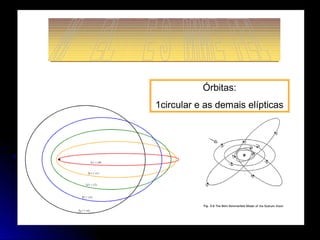
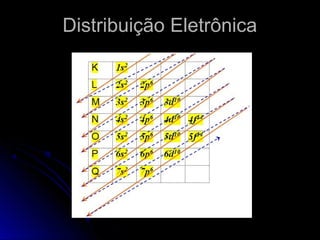
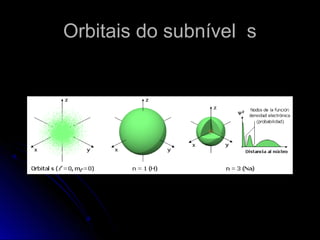
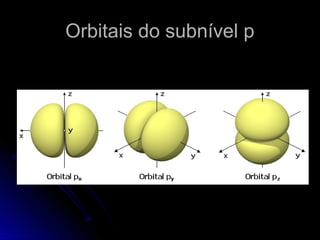
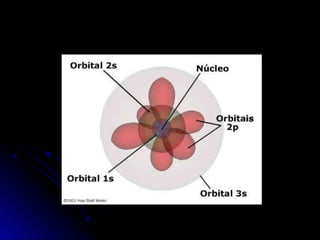
O documento discute a evolução dos modelos atômicos, começando pelo modelo de Thomson em 1909, passando pelo modelo de Rutherford em 1911 e modelo de Bohr em 1913, até chegar no modelo atômico atual proposto por Schrödinger em 1933. O modelo atual descreve os elétrons como nuvens de probabilidade ao redor do núcleo, em vez de órbitas definidas, refletindo a natureza ondulatória dos elétrons.