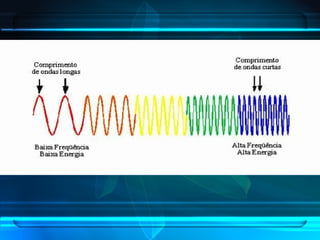
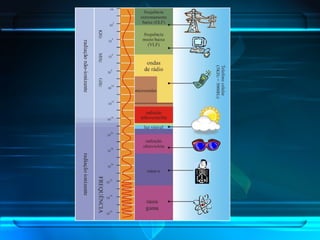
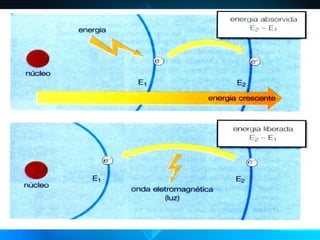
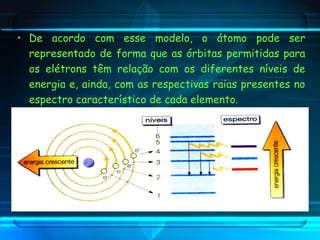
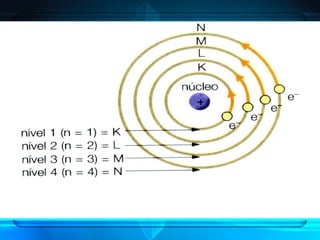
O documento descreve o Modelo Atômico de Bohr, que propôs que os elétrons podem ocupar apenas órbitas circulares com energia quantizada ao redor do núcleo, explicando assim os espectros de linhas atômicos. O modelo mantém as características do Modelo de Rutherford e introduz postulados como a quantização dos níveis de energia e saltos quânticos dos elétrons entre esses níveis.