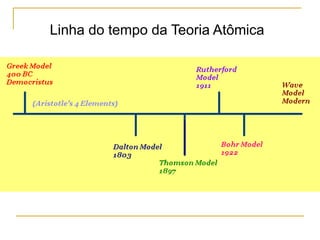
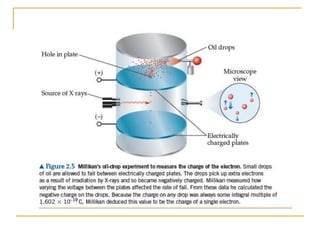
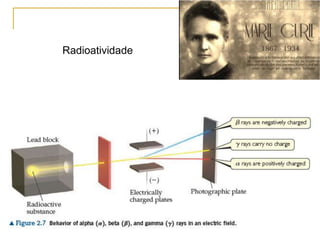
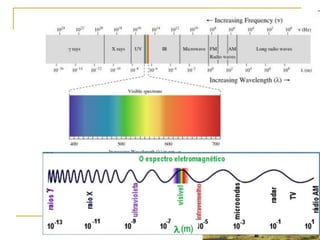
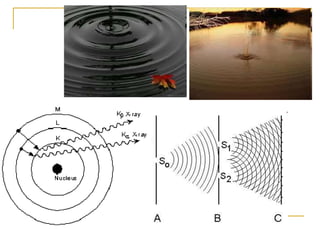
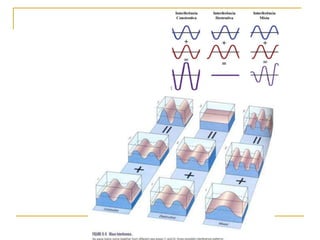
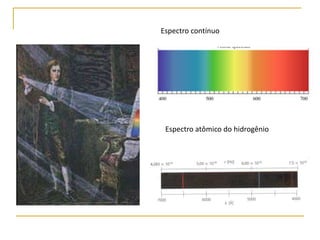
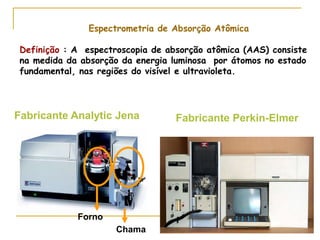
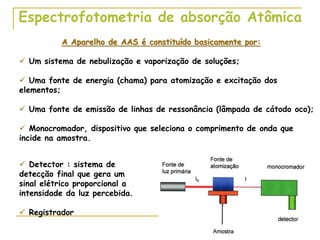
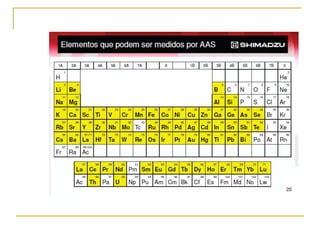
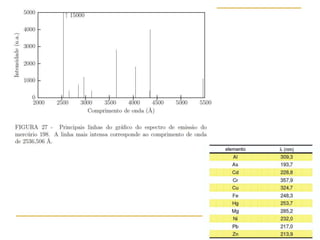
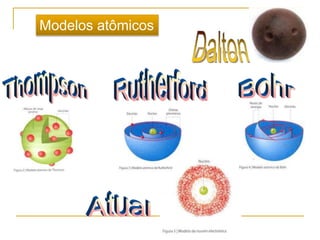
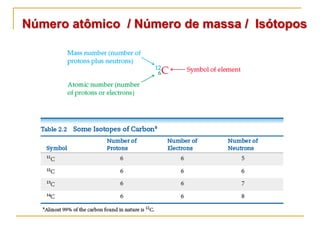
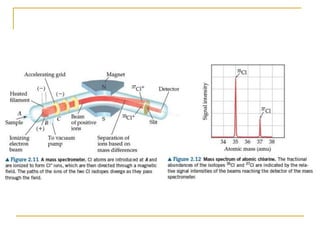
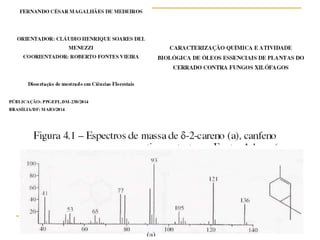
1) O documento descreve a evolução dos modelos atômicos ao longo do tempo, desde a ideia de átomo proposto por filósofos gregos até os modelos modernos.
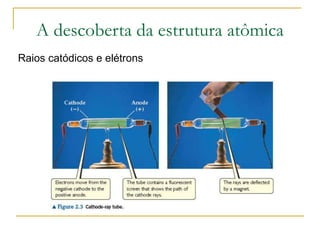
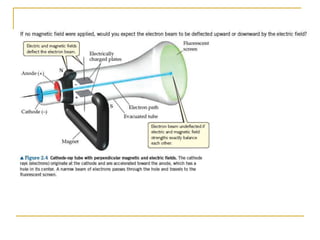
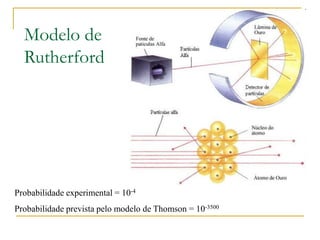
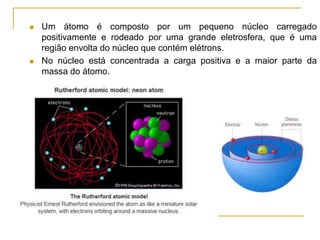
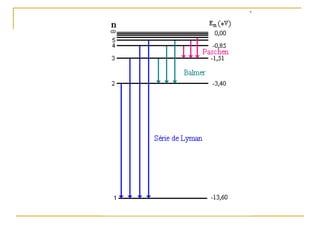
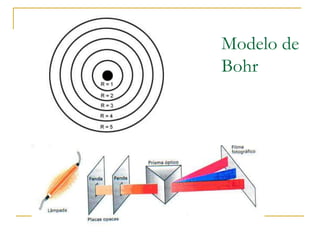
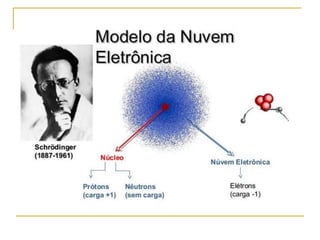
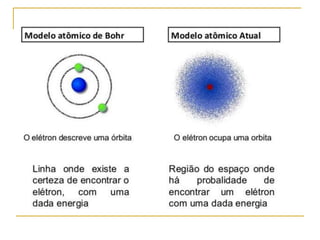
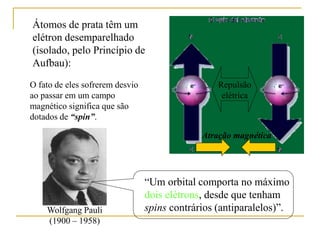
2) São apresentados os principais modelos como o de Thomson, Rutherford, Bohr e a introdução dos números quânticos por Sommerfeld.
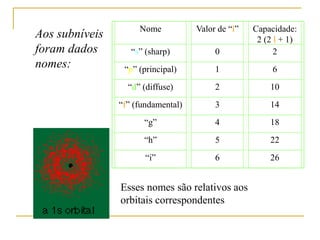
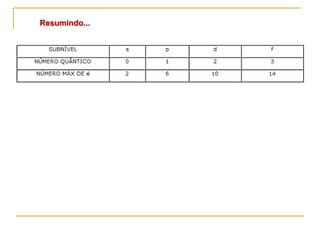
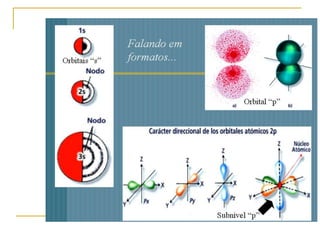
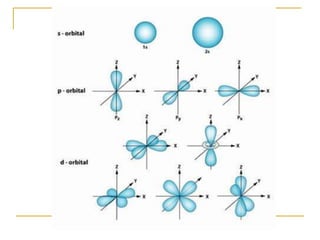
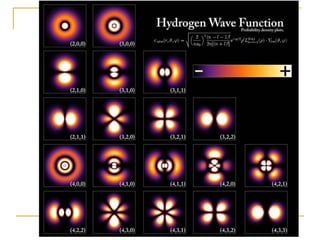
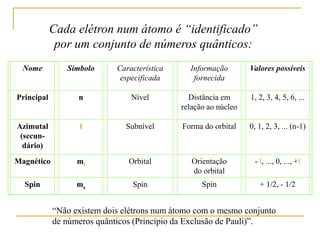
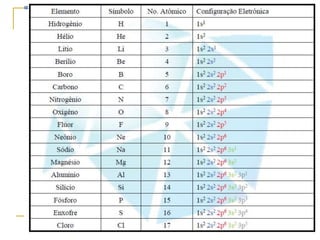
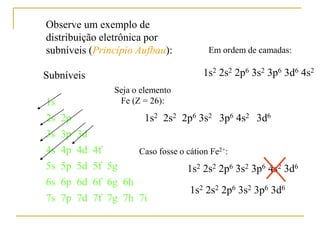
3) O modelo atômico moderno é baseado na estrutura eletrônica dos átomos definida por seus números quânticos.