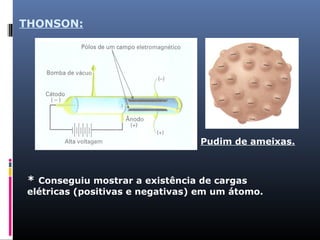
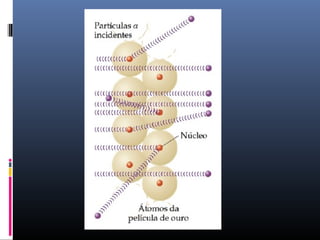
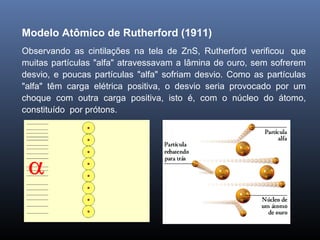
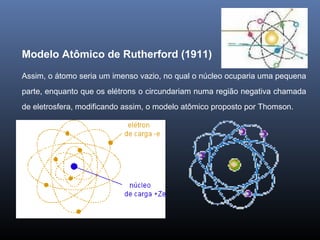
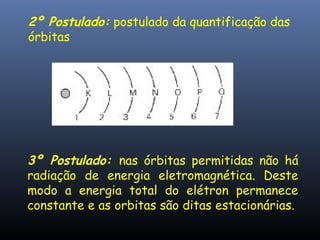
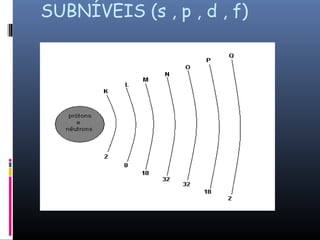
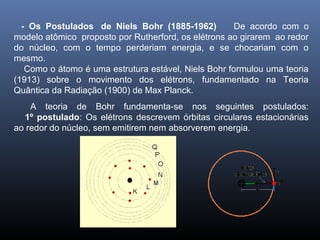
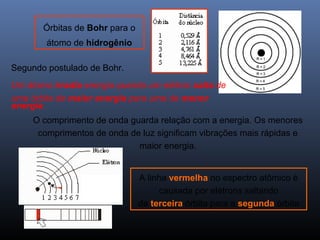
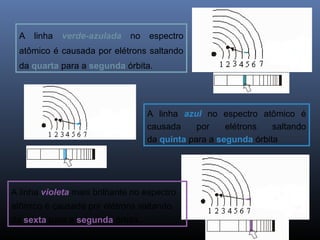
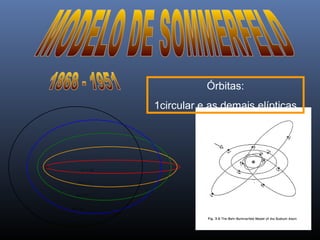
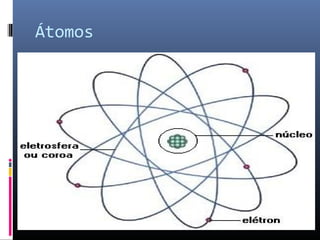
O documento descreve a evolução dos modelos atômicos ao longo da história, começando com o primeiro modelo filosófico de Demócrito e Leucipo no século V a.C., passando pelas contribuições de Dalton, Thomson, Rutherford e Bohr até o desenvolvimento do modelo atômico moderno com a introdução dos números quânticos e conceitos como órbitas eletrônicas e níveis de energia.