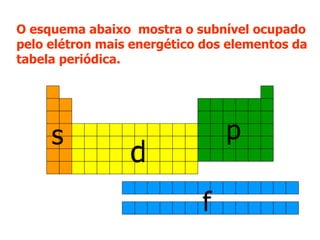
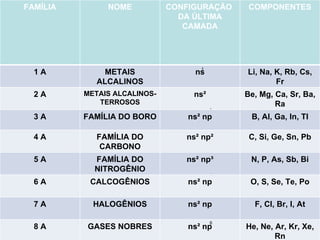
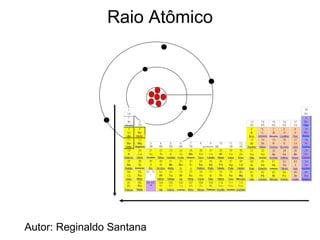
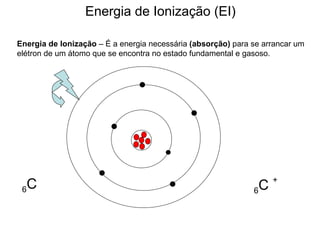
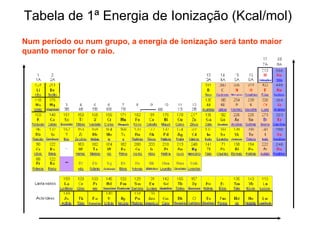
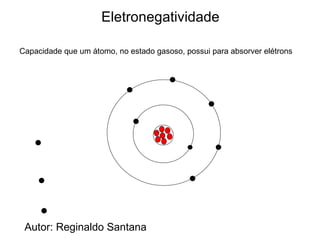
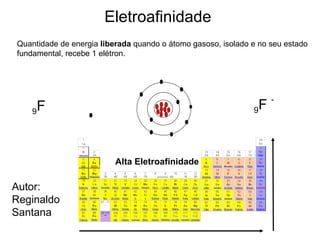
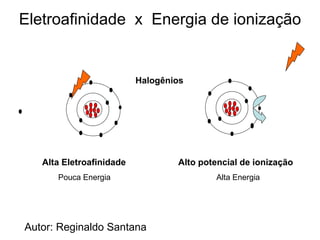
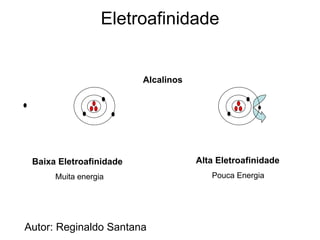
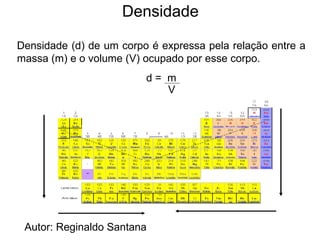
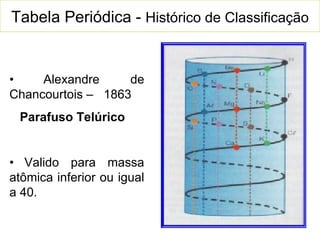
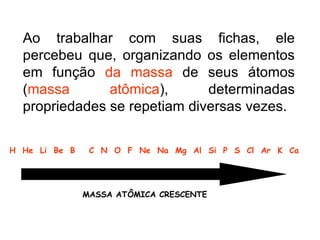
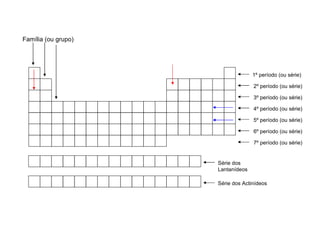
O documento descreve a história da classificação da tabela periódica dos elementos, desde as primeiras tentativas de organizá-los até a tabela atual. Explica que Mendeleev foi o primeiro a organizar os elementos de forma sistemática com base em suas massas atômicas, antecipando lacunas para elementos ainda desconhecidos. Posteriormente, Moseley demonstrou que a organização deve seguir a ordem crescente dos números atômicos.










![TABELA PERIÓDICA Metais Alcalinos ns 1 Metais Alcalinos Terrosos ns 2 Calcogênio Halogênio Gases Nobres ns 2 p 1 ns 2 p 6 ns 2 p 2 ns 2 p 3 ns 2 p 4 ns 2 p 5 Elementos Representativos Terminados e s e p Autor: Reginaldo Santana Metais de Transição Externa 26 Fe – [Ar] 4s 2 3d 6 40 Zr – [Kr] 5s 2 4d2 Metais de Transição interna 58 Ce – [Xe] 6s 2 4f 2 90 Th – [Rn] 7s 2 5f 2 k L M N O P Q](https://image.slidesharecdn.com/tabelaperidicacas-100524062834-phpapp02/85/Tabela-periodica-cas-14-320.jpg)