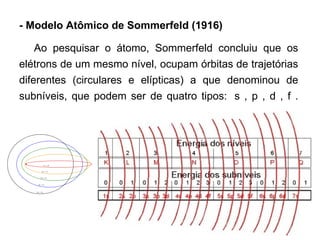
1) O documento descreve a evolução dos modelos atômicos desde a Grécia Antiga até os modelos atômicos modernos, incluindo as contribuições de Demócrito, Dalton, Thomson, Rutherford, Bohr, Schrödinger e outros.
2) Os modelos evoluíram da ideia de átomos indivisíveis para a compreensão de que átomos são compostos por núcleos e elétrons.
3) A mecânica quântica revelou que elétrons se comportam como partículas e ondas