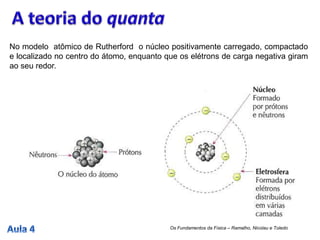
1. O modelo atômico de Rutherford propôs que o átomo possui um núcleo positivamente carregado no centro, com elétrons girando em órbitas ao seu redor
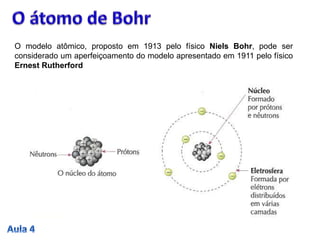
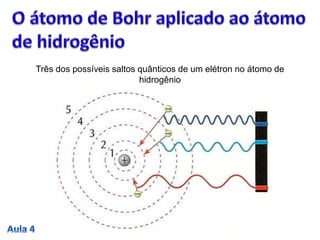
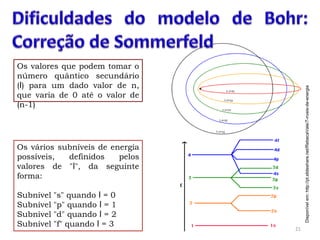
2. O modelo de Bohr aperfeiçoou o modelo de Rutherford, propondo que os elétrons descrevem órbitas circulares estáveis em torno do núcleo, chamadas de estados estacionários
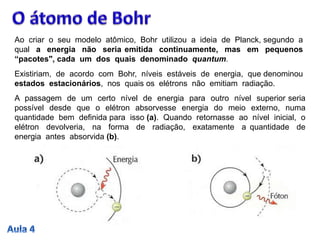
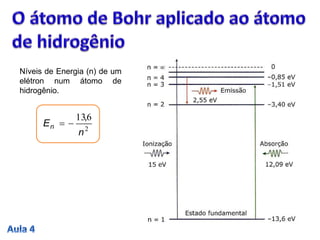
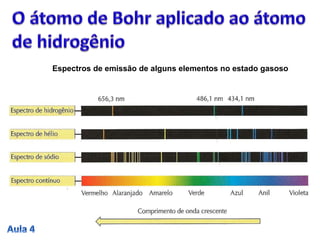
3. A passagem do elétron entre estados estacionários envolve a absorção ou emissão de quanta de energia definidos pela const