1) A física quântica estabelece que a energia é absorvida ou emitida pelos átomos em "pacotes" chamados quanta durante transições entre níveis de energia.
2) O modelo atômico de Bohr descreve o átomo como um núcleo circundado por elétrons em órbitas circulares quantizadas, onde os elétrons só podem assumir certos níveis de energia.
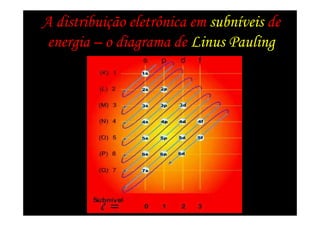
3) Modelos posteriores dividiram as órbitas eletrônicas em níveis e sub