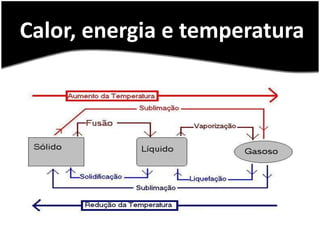
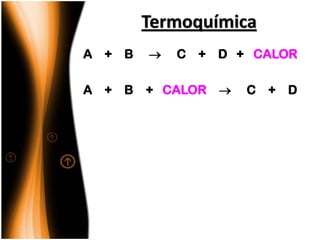
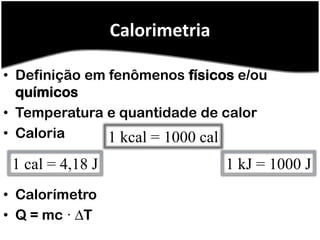
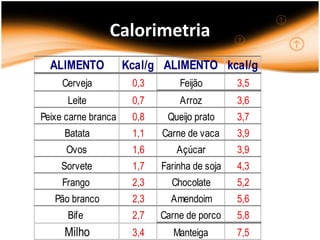
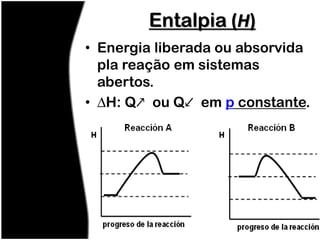
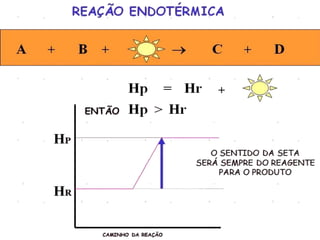
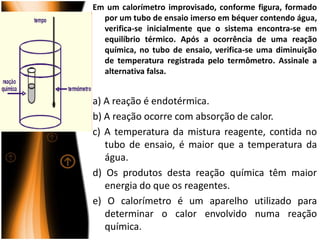
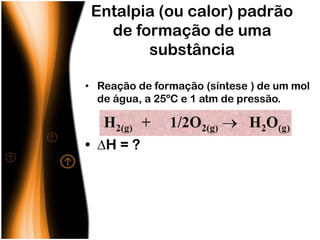
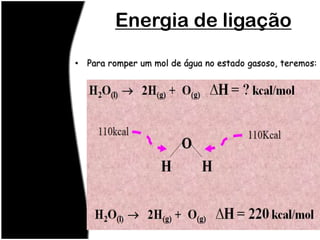
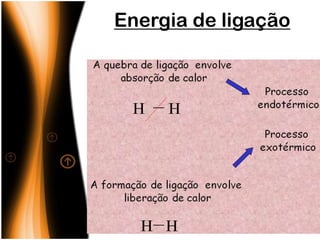
O documento discute termos relacionados à termoquímica, incluindo:
1) Reações químicas podem liberar ou absorver calor;
2) Calorimetria mede a quantidade de calor envolvida em reações;
3) Entalpia representa a variação de calor em reações a pressão constante.