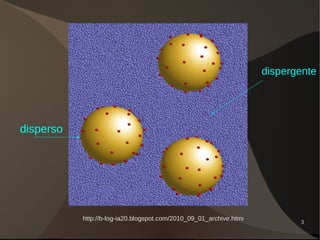
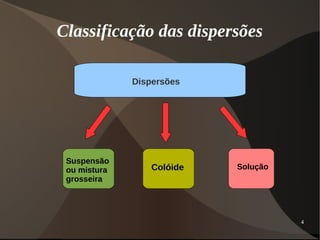
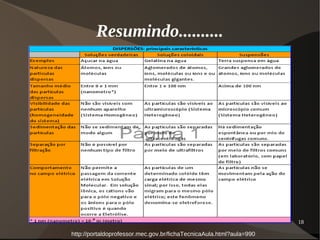
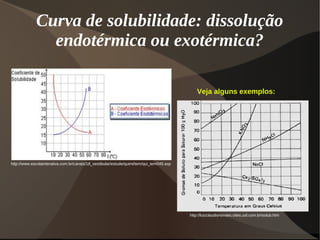
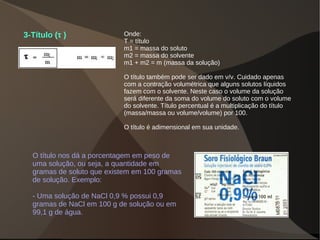
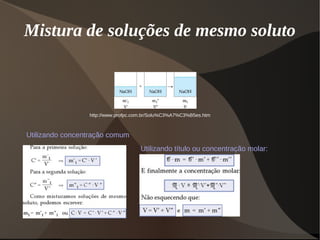
Este documento discute os conceitos de dispersões, colóides e soluções. Ele define dispersões como misturas de duas ou mais substâncias onde uma fase está distribuída na outra. Colóides são dispersões com partículas entre 1-100 nm, enquanto suspensões têm partículas acima de 100 nm. Soluções têm suas partículas dispersas na escala molecular ou iônica. O documento também discute propriedades como o efeito Tyndall e movimento browniano em colóides, além de classificar e explicar aspectos de soluções