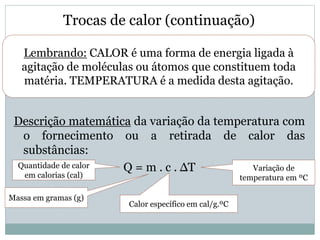
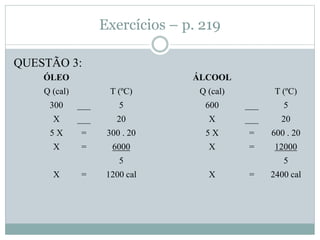
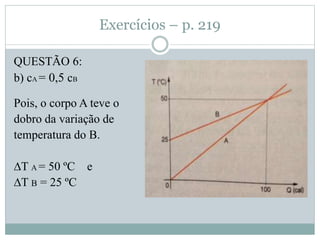
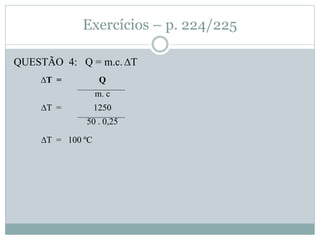
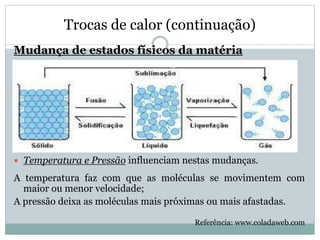
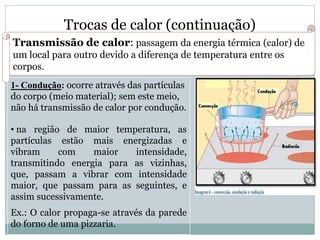
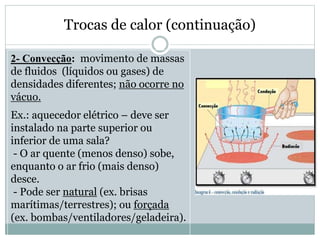
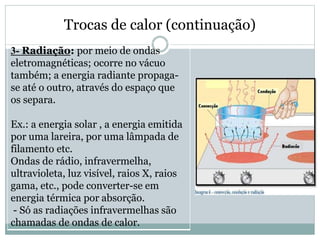
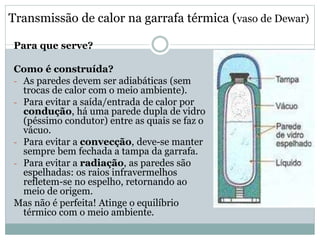
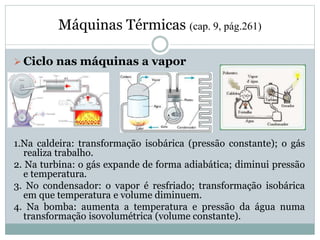
Este documento discute os conceitos de trocas de calor e mudança de estado da matéria. Explica que diferentes substâncias necessitam de quantidades diferentes de calor para variar sua temperatura, dependendo de sua massa e calor específico. Também descreve os estados físicos da matéria - sólido, líquido e gasoso - e as transformações entre eles como fusão, ebulição e mudanças de estado quando calor é adicionado ou removido de um sistema.