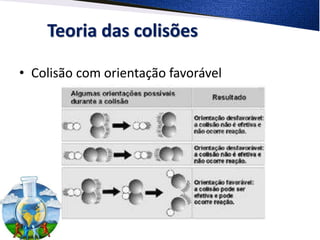
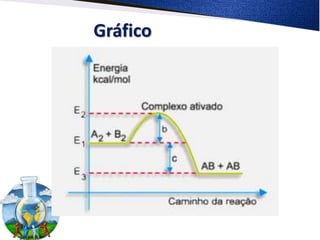
O documento discute cinética química, efeito estufa, reação de combustão e como controlar a rapidez de reações. A teoria das colisões explica que uma reação ocorre quando as moléculas colidem com orientação e energia favoráveis, formando um complexo ativado instável entre reagentes e produtos.