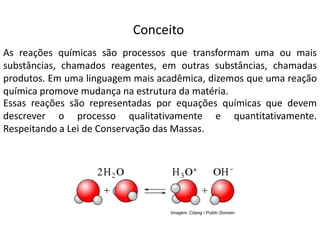
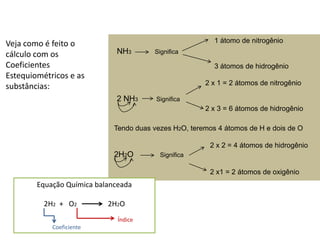
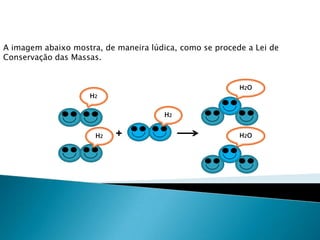
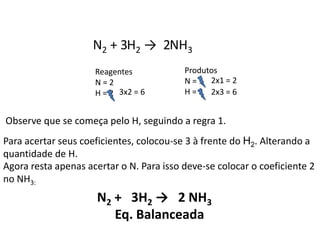
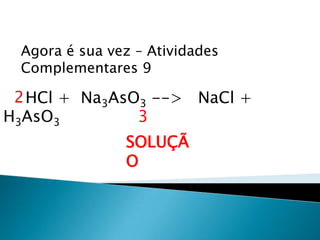
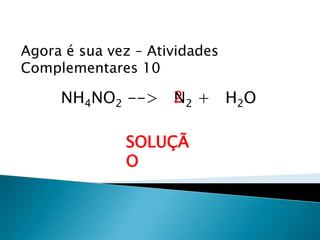
1) O documento discute balanceamento químico e como balancear equações químicas respeitando a lei da conservação da massa. 2) É fornecido um guia passo-a-passo para balancear equações químicas usando coeficientes estequiométricos. 3) Exemplos de equações químicas balanceadas são fornecidos para ilustrar o processo.