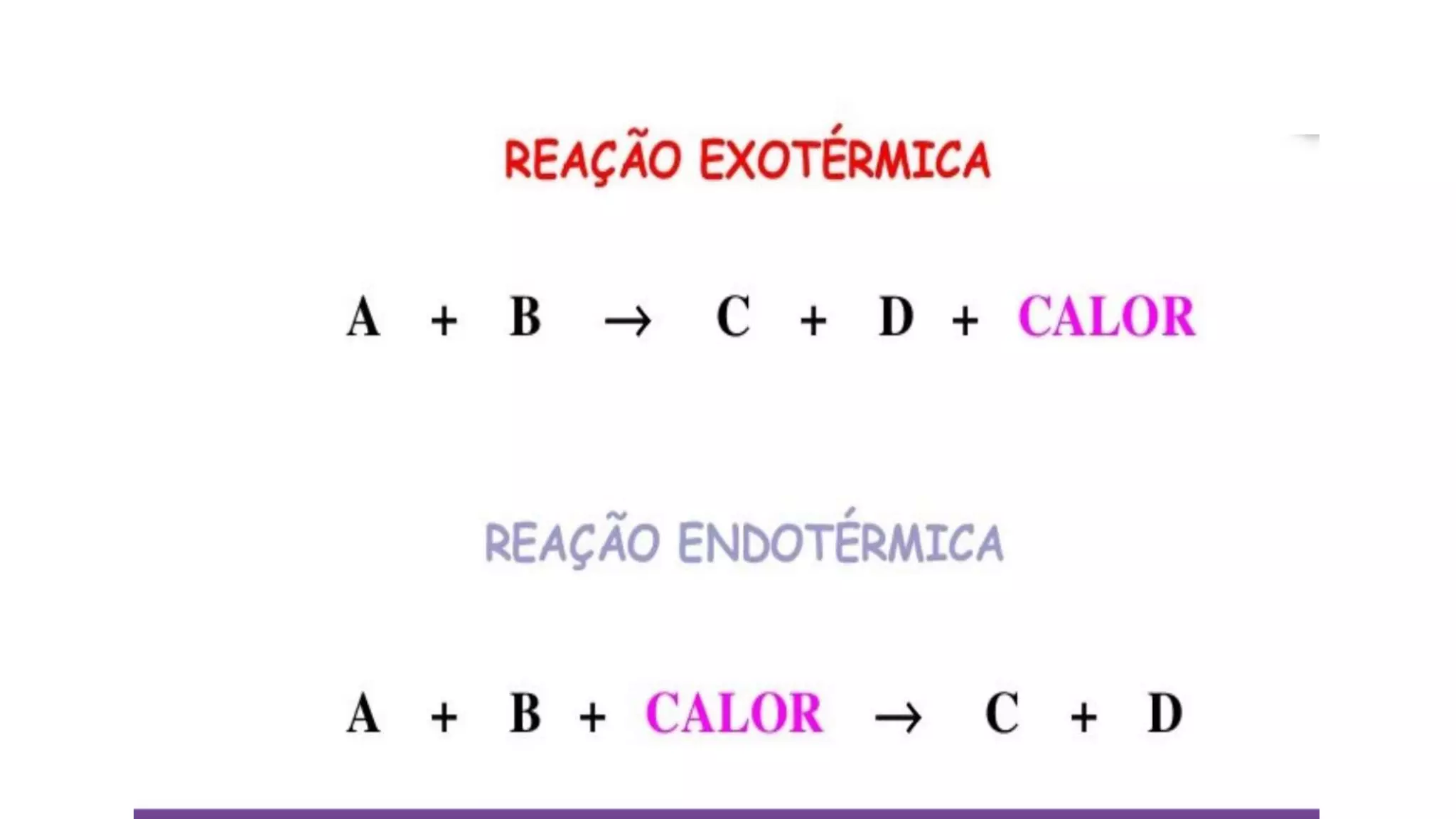
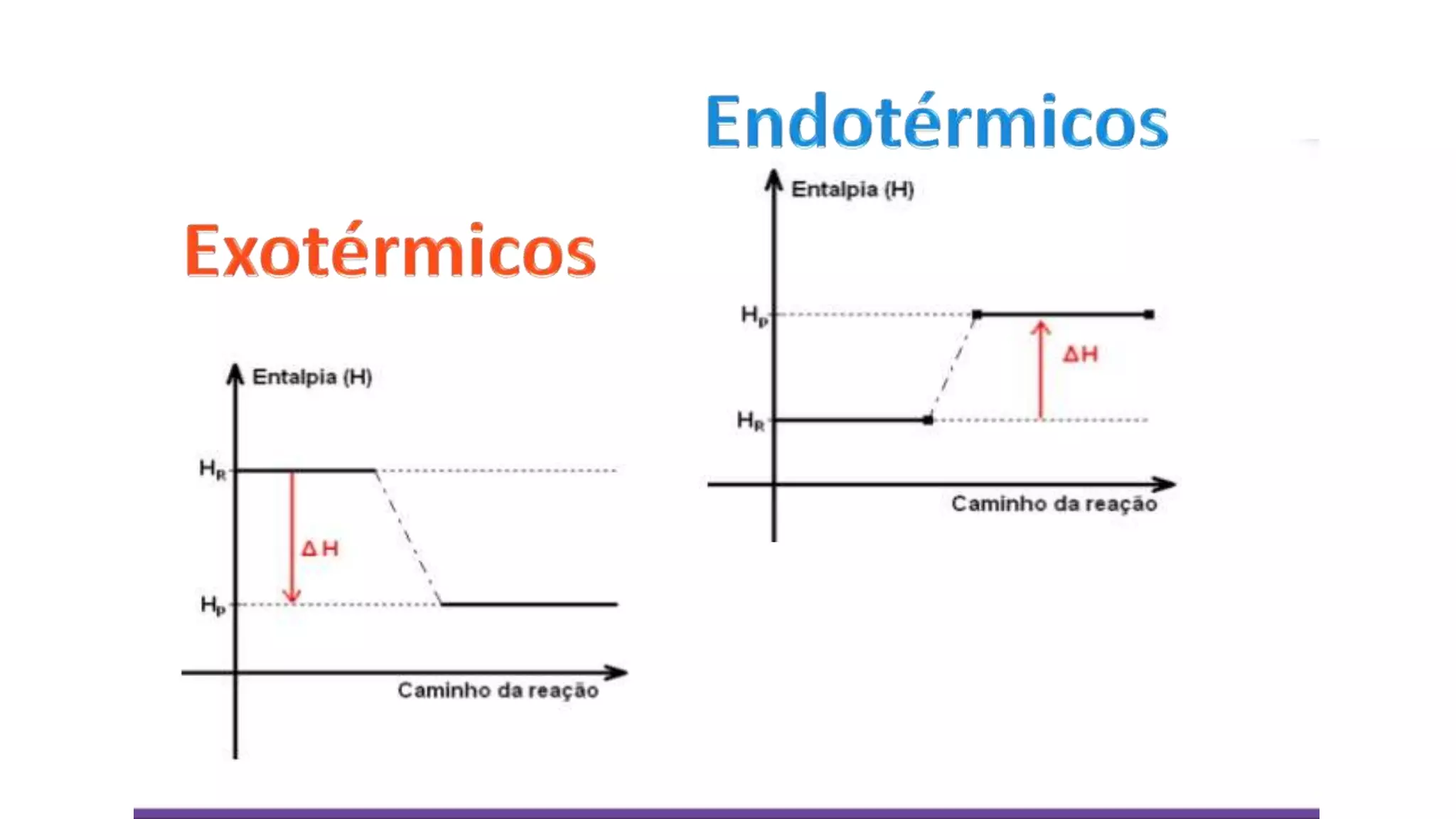
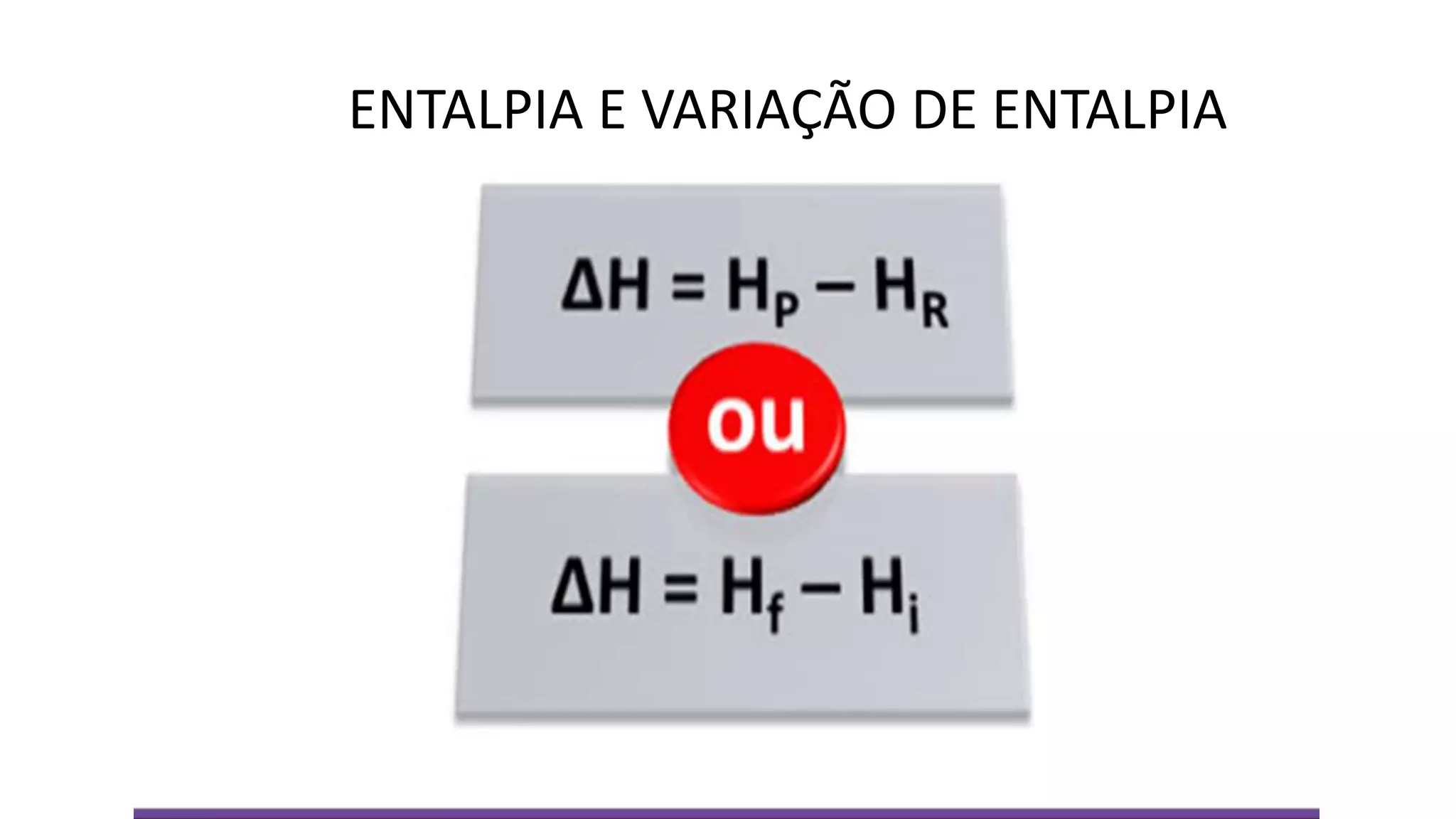
O documento discute conceitos de termoquímica como reações endotérmicas e exotérmicas, entalpia, variação de entalpia e unidades de medição de calor. Ele fornece exemplos de processos endotérmicos e exotérmicos e explica como calcular a variação de entalpia de uma reação química.