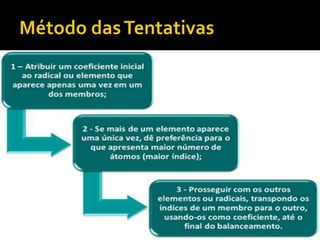
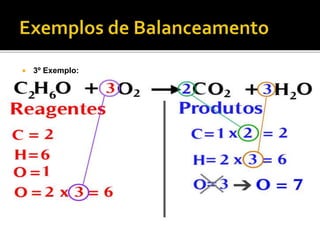
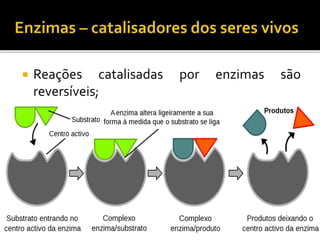
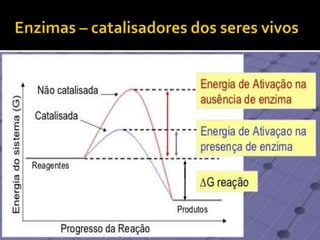
1) Uma reação química envolve a transformação de substâncias em novas substâncias através da formação ou quebra de ligações químicas. 2) Enzimas são proteínas que catalisam reações químicas nos seres vivos, acelerando as reações sem serem alteradas no processo. 3) As leis da conservação da massa e das proporções definidas estabelecem que a massa total é conservada nas reações químicas e as proporções dos reagentes e produtos são sempre constantes.