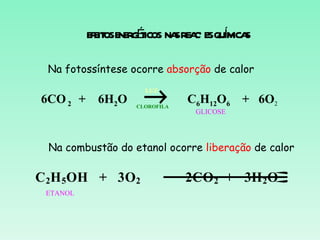
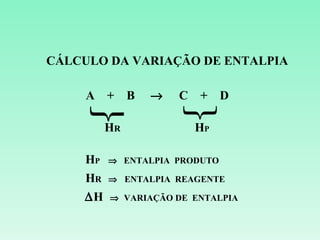
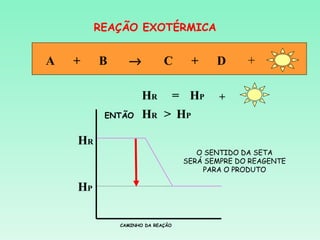
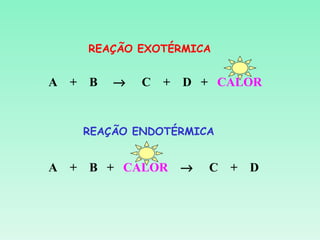
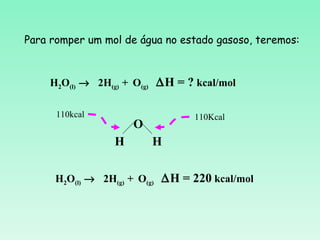
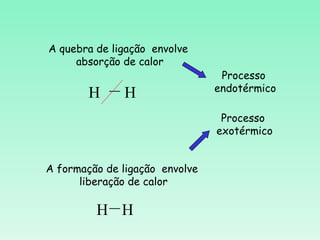
O documento discute conceitos fundamentais da termoquímica, incluindo:
1) A termoquímica estuda as mudanças térmicas em reações químicas;
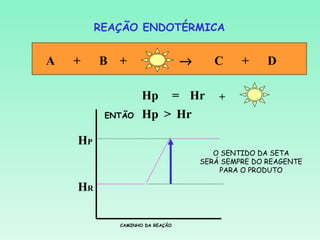
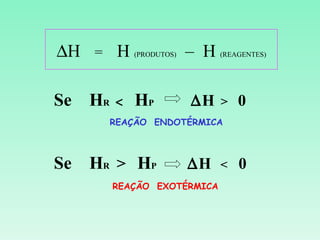
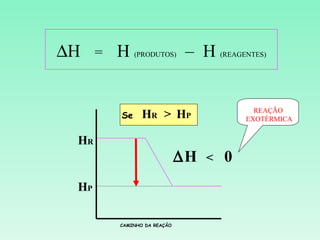
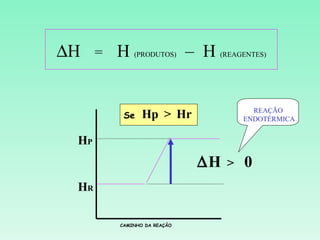
2) Reações podem ser exotérmicas ou endotérmicas dependendo se liberam ou absorvem calor;
3) O cálculo da variação de entalpia de uma reação depende das entalpias dos reagentes e produtos.