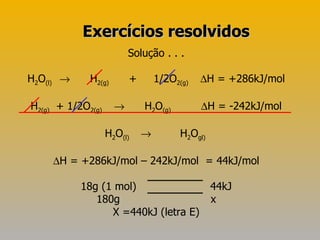
1) O documento discute termos da termoquímica, incluindo lei de Hess e cálculo de variação de entalpia em reações químicas.
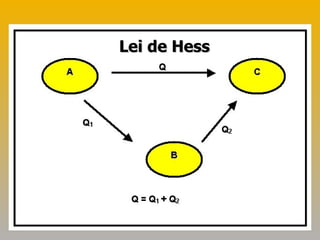
2) A lei de Hess estabelece que a variação de entalpia de uma reação depende apenas das entalpias iniciais e finais, não do caminho.
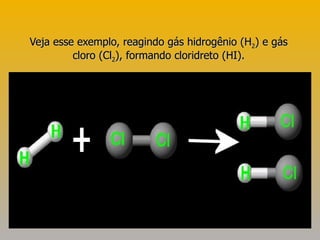
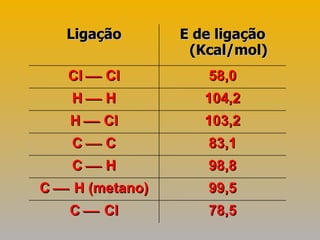
3) Exemplos demonstram como usar a lei de Hess para calcular variações de entalpia indiretamente.






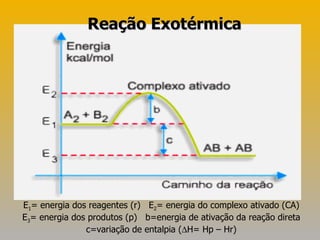


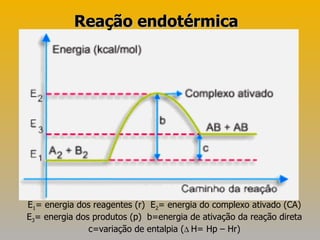




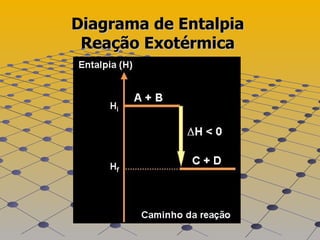
![Exercícios 06)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a variação de entalpia é [3] que zero. Completa-se corretamente essa frase substituindo-se [1], [2] e [3], respectivamente, por: a) liberação, maior, maior. b) absorção , maior, menor. c) liberação, menor, menor. d) absorção, menor, maior. e) liberação, maior, menor.](https://image.slidesharecdn.com/termoqumica-110515082447-phpapp01/85/Termoquimica-15-320.jpg)