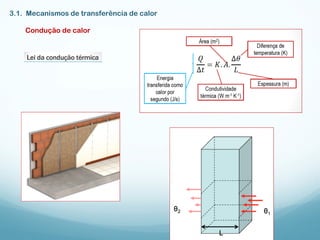
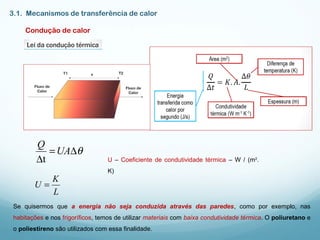
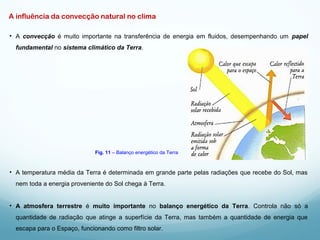
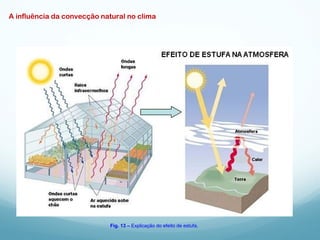
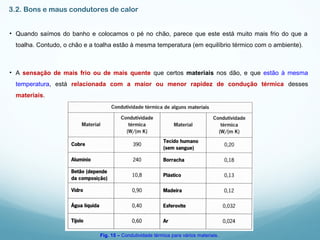
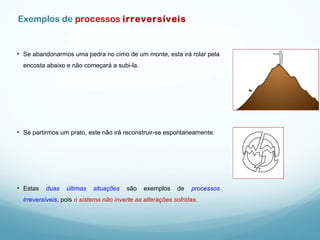
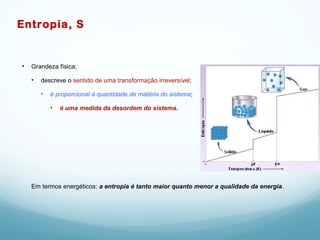
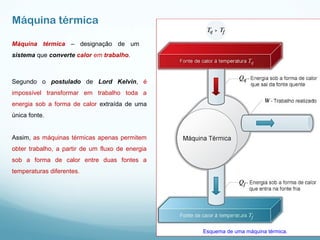
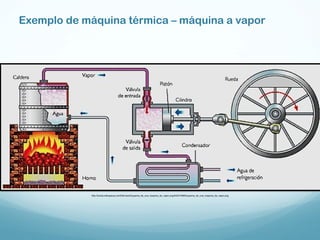
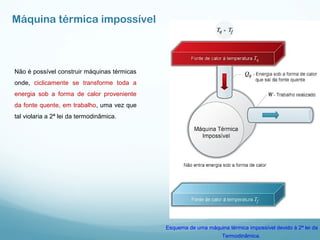
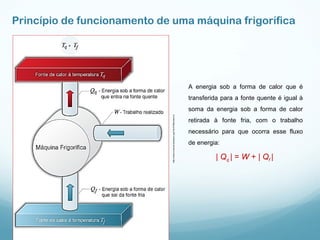
1) A Termodinâmica estuda as transformações de energia térmica (calor) em outras formas de energia.
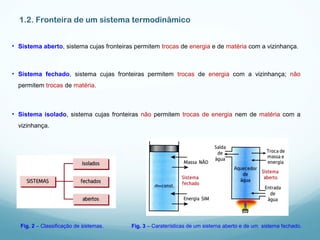
2) Um sistema termodinâmico é um conjunto de partículas que pode interagir com o ambiente através de suas fronteiras. Sistemas podem ser abertos, fechados ou isolados dependendo se permitem ou não trocas de energia e matéria.
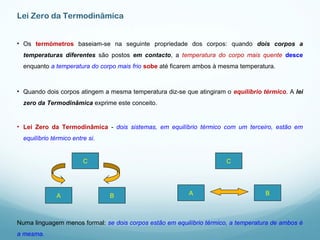
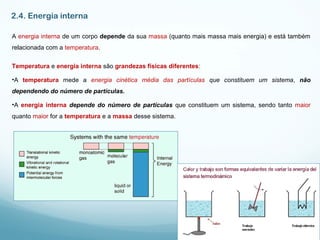
3) Variáveis como temperatura, pressão, volume e energia interna caracterizam o estado termodinâmico de um sistema e suas relações descreve