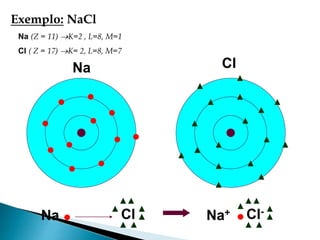
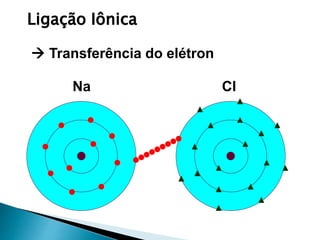
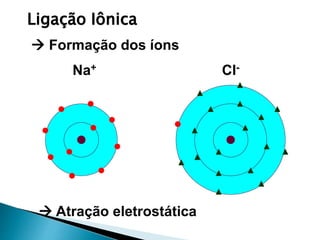
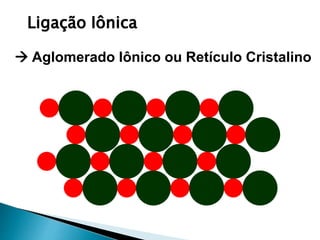
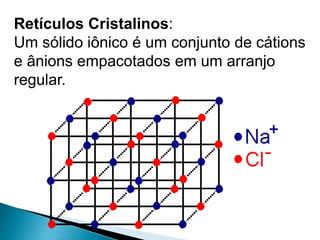
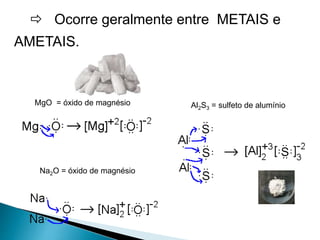
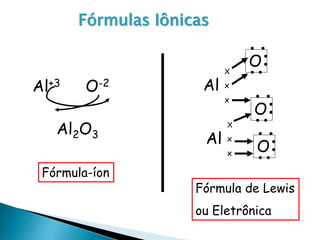
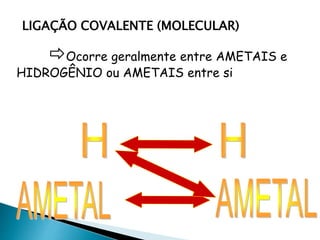
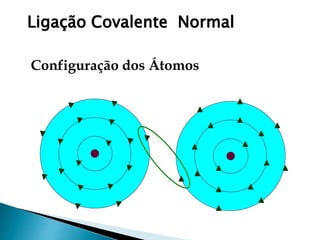
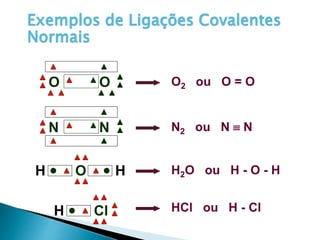
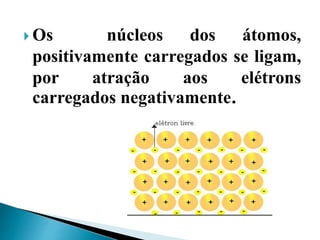
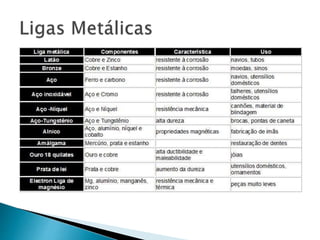
O documento discute os tipos de ligação química, incluindo iônica, covalente e metálica. Explica como cada tipo de ligação ocorre dependendo da transferência ou compartilhamento de elétrons entre os átomos. Também descreve as propriedades distintivas dos compostos formados por cada tipo de ligação.