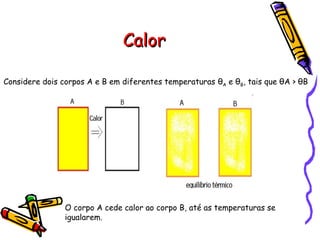
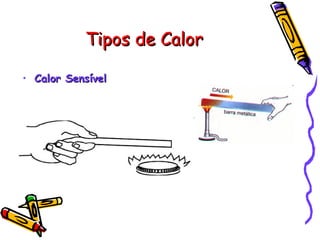
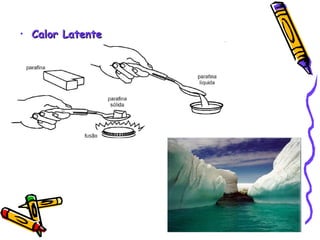
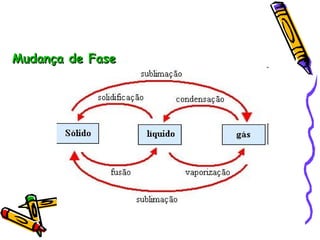
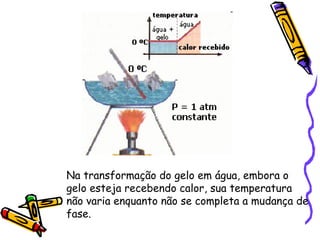
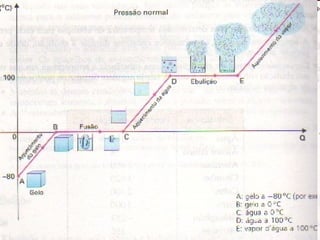
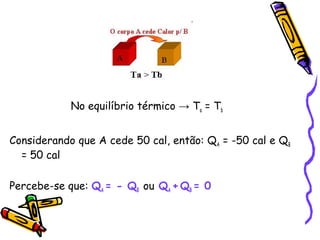
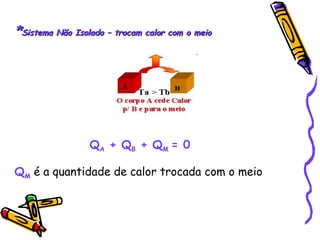
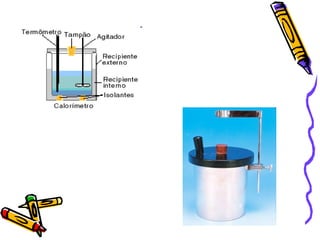
O documento fornece informações sobre calorimetria, definindo conceitos como calor, calor sensível, calor latente, capacidade térmica e equações fundamentais da calorimetria. Exemplos de substâncias e suas propriedades térmicas também são apresentados.