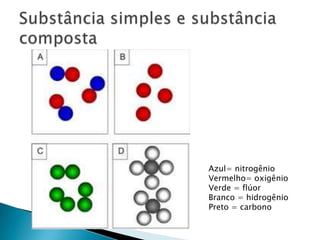
O documento discute conceitos fundamentais da química como molécula, massa atômica, mol, volume molar e quantidade de matéria. Explica que uma molécula é composta de pelo menos dois átomos e apresenta a hipótese de Avogadro de que volumes iguais de gases contém o mesmo número de moléculas. Também define o que é massa atômica e molecular e como medir a quantidade de matéria em mols.