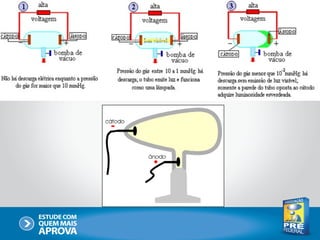
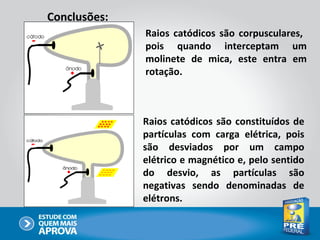
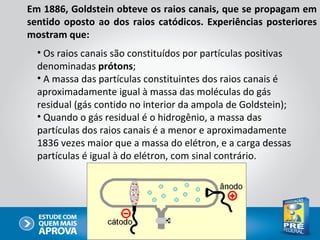
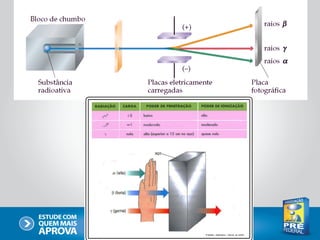
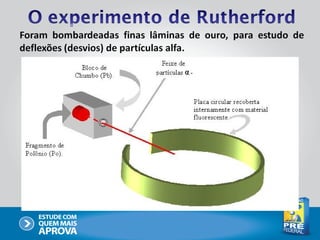
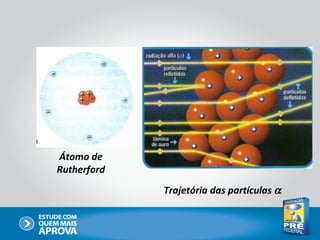
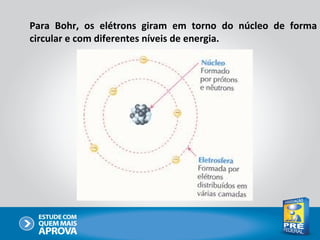
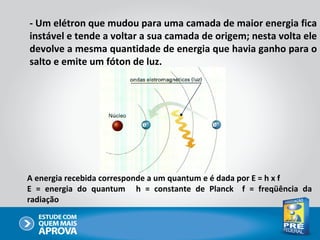
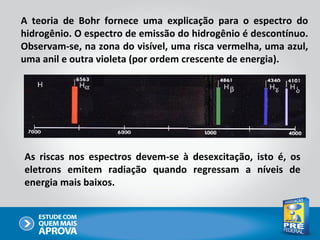
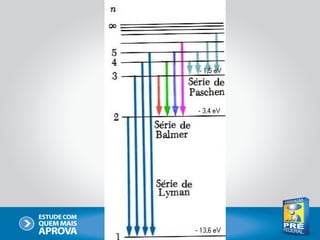
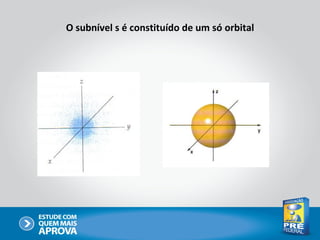
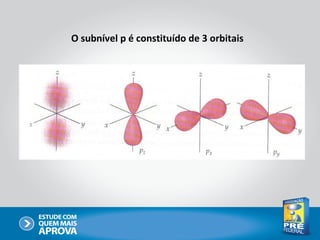
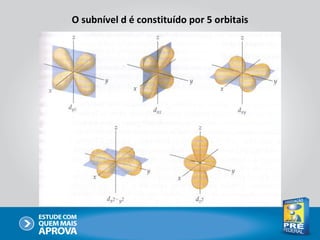
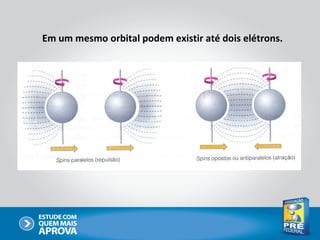
O documento descreve a evolução do modelo atômico ao longo do tempo, começando com Dalton e sua teoria atômica, passando pelas descobertas de Thomson, Rutherford, Bohr e outros, até chegar no modelo atômico atual baseado nos princípios da mecânica quântica.