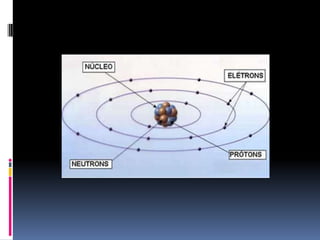
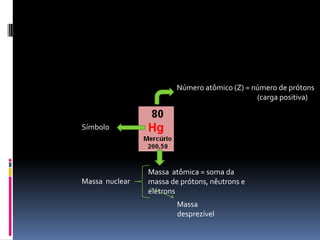
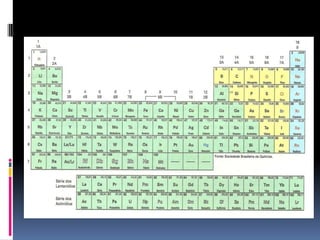
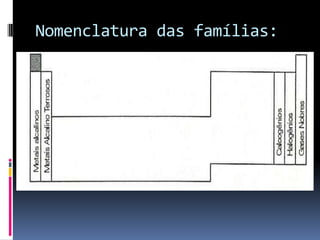
O documento é uma aula sobre a Tabela Periódica destinada a alunos da Associação Pré-Federal. A aula explica conceitos básicos como número atômico, massa atômica, organização da tabela periódica em famílias e períodos, e classificação dos elementos em metais, ametais, gases nobres e hidrogênio.