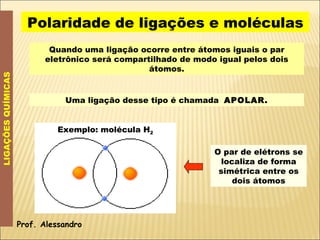
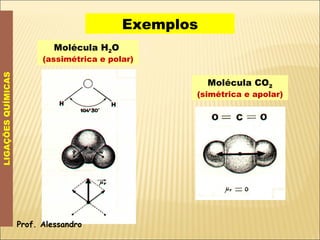
O documento discute a polaridade de ligações químicas e moléculas. Explica que ligações entre átomos iguais são apolares, enquanto ligações entre átomos com diferentes eletronegatividade são polares, com o polo negativo próximo ao átomo mais eletronegativo. Quanto maior a diferença de eletronegatividade, mais polarizada é a ligação. A polaridade molecular depende da geometria e do somatório dos vetores momento dipolar das ligações. Moléculas simétricas são apolares