1) Estequiometria estuda as relações quantitativas entre substâncias em reações químicas.
2) Uma mol é medida em átomos, moléculas, massa ou volume.
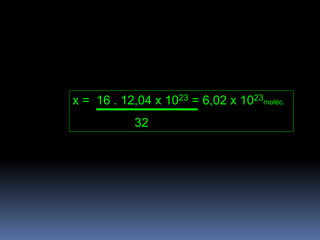
3) Cálculos estequiométricos determinam quantidades de substâncias usando equações de reação e proporções.