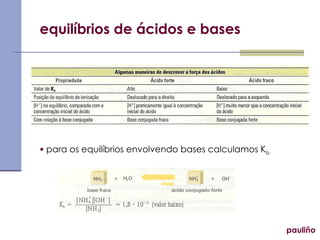
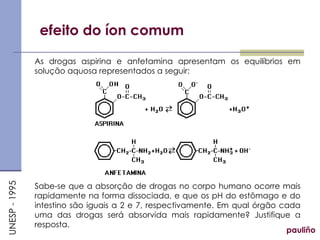
O documento discute vários tópicos relacionados a equilíbrios químicos, incluindo: equilíbrio iônico da água, pH e pOH, indicadores, soluções tampão, hidrólise salina, produto de solubilidade e seus cálculos. Explica como calcular os índices de dissociação e constantes de equilíbrio para reações ácido-base e como prever a ocorrência ou não de precipitação baseado no produto de solubilidade.









![equilíbrio iônico da água pauliño Auto-ionização da água H 2 O (l) H + (aq) + OH - (aq) ou 2H 2 O (l) H 3 O + (aq) + OH - (aq) Como se trata de um equilíbrio, podemos calcular o K i : K i = [H + ] . [OH - ] [H 2 O] K i . [H 2 O] = [H + ] . [OH - ] K w = [H + ] . [OH - ] constante muito grande](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-12-320.jpg)
![equilíbrio iônico da água K w = [H + ] . [OH - ] Produto iônico da água constante iônica da água varia só com a temperatura! IMPORTANTE! T=25 o C e P= 1atm K w = 1,0 . 10 -14 (mol/L) 2 ou seja: [H + ] = 1,0 . 10 -7 mol/L [OH - ] = 1,0 . 10 -7 mol/L o aumento da T, aumenta o K w , pois aumenta a conc. dos íons, logo concluímos que ionização da água é um processo endotérmico.](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-13-320.jpg)
![equilíbrio iônico da água sempre que aumentar a [H + ], a [OH - ] irá diminuir sempre que aumentar a [OH-], a [H+] irá diminuir, assim: SOLUÇÕES NEUTRAS: [H+] = [OH-] SOLUÇÕES ÁCIDAS: [H+] [OH-] SOLUÇÕES BÁSICAS: [OH-] [H+] pauliño](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-14-320.jpg)
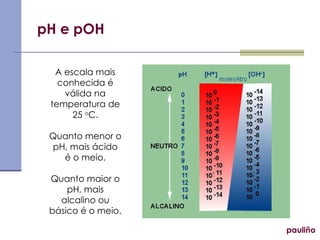
![pH e pOH pauliño Escala criada pelo dinamarquês Sörensen para Carlsberg em 1909 que facilita o tratamento das informações de concentrações. Potencial Hidrogeniônico Potencial Hidroxiliônico pH = - log [H + ] pOH = - log [OH - ] pH + pOH = 14 Relação entre pH e pOH](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-15-320.jpg)



![hidrólise salina Sal de ácido forte e base forte: solução neutra Sal de ácido fraco e base fraca: depende dos K a e K b se K a K b : solução ácida se K b K a : solução básica NH 4 HCO 3 + H 2 O = NH 4 OH + H 2 CO 3 K b K a : [OH _ ] [H + ] NaCl + H 2 O = NaOH + HCl (não ocorre) pauliño](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-21-320.jpg)
![hidrólise salina Parâmetros Quantitativos Grau de Hidrólise: h = n hidrolisados /n dissolvidos Constante de Hidrólise (eq. iônica): K h = [prod] p / [reag] r (- H 2 O) Sal de ácido forte e base fraca: K h = K w /K b Sal de ácido fraco e base forte: K h = K w /K a Sal de ácido e base fracas: K h = K w /K a .K b pauliño](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-22-320.jpg)
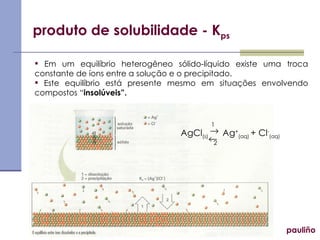

![produto de solubilidade - K ps pauliño C x+ y A y- x (s) = yC x+ (aq) + xA y- (aq) K ps = [C x+ ] y [A y- ] x](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-25-320.jpg)


![produto de solubilidade - K ps pauliño Prevendo a Precipitação C x+ y A y- x (s) = yC x+ (aq) + xA y- (aq) K ps = [C x+ ] y [A y- ] x Se [C x+ ] y [A y- ] x = K ps Se [C x+ ] y [A y- ] x K ps Se [C x+ ] y [A y- ] x K ps Solução Saturada Solução Insaturada Solução Supersaturada , ocorre precipitação até que o K ps seja atingido.](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-28-320.jpg)


![resposta! [Ca 2+ ] 3 [PO 4 3- ] 2 = [2.10 -3 ] 2 [5.10 -6 ] 3 = 5.10 -22 (mol/L) 5 Maior que o Kps - precipitação [Ca 2+ ][C 2 O 4 2- ] = [2.10 -3 ] [1.10 -7 ] = 2.10 -10 (mol/L) 2 Menor que o Kps – sem precipitação pauliño](https://image.slidesharecdn.com/equilbrioinico2colanglo-091027060017-phpapp01/85/Equilibrio-Ionico-31-320.jpg)

