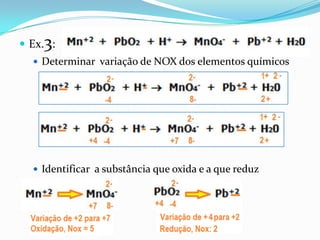
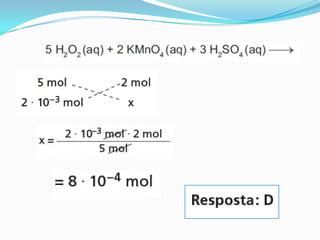
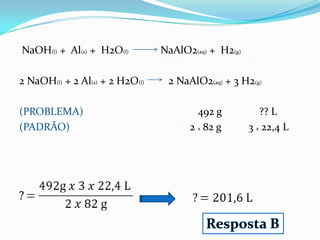
O documento apresenta uma receita de bolo e discute conceitos de estequiometria, incluindo reações químicas e balanceamento. Também aborda a importância de ligas de estanho-chumbo na soldagem e os componentes de uma bateria automotiva, além do tratamento de água em estações de tratamento. Exemplos de cálculos estequiométricos são fornecidos, como determinar quantidades de reagentes e produtos em reações, bem como o rendimento de processos químicos.