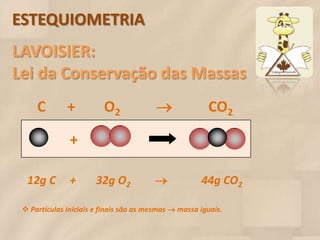
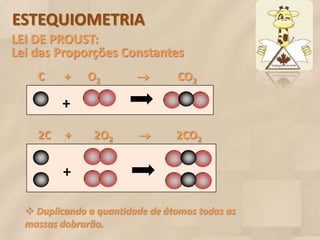
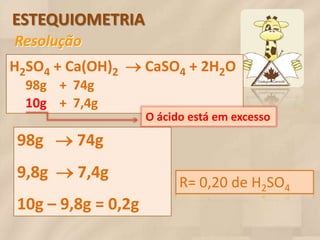
O documento discute estequiometria, que é o estudo das relações quantitativas entre substâncias em reações químicas. A estequiometria baseia-se nas leis da conservação da massa e das proporções definidas, significando que a quantidade de cada elemento é a mesma antes, durante e após uma reação. Exemplos demonstram como calcular relações de massa e volume usando coeficientes em equações químicas.