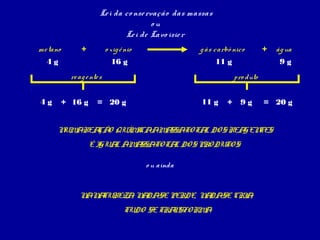
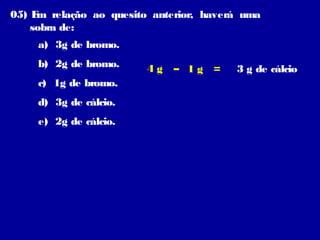
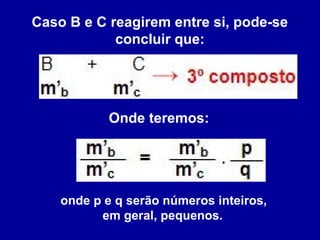
Este documento descreve as principais leis das reações químicas, divididas em leis ponderais e leis volumétricas. As leis ponderais incluem a lei da conservação das massas, lei de Lavoisier e lei das proporções múltiplas. As leis volumétricas descrevem as relações entre os volumes dos gases que reagem e participam das reações químicas.