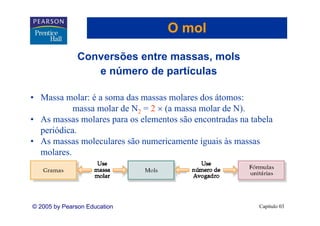
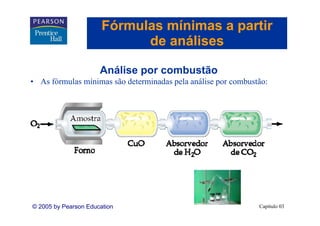
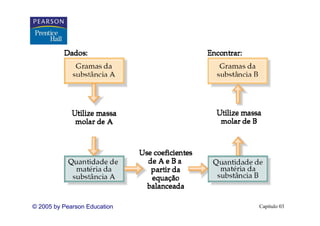
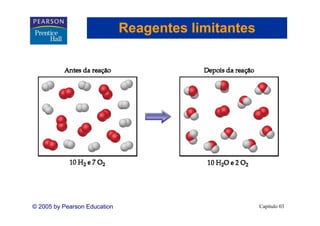
Este capítulo apresenta os conceitos fundamentais de estequiometria, incluindo: 1) Equações químicas representam reações através de reagentes e produtos; 2) Coeficientes estequiométricos fornecem as proporções de reagentes e produtos; 3) Reações são balanceadas de acordo com a lei da conservação da massa.