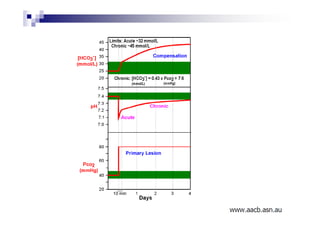
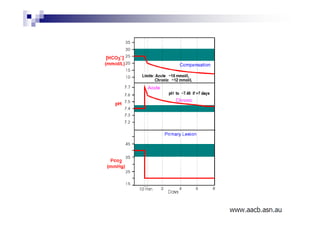
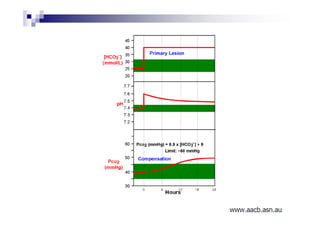
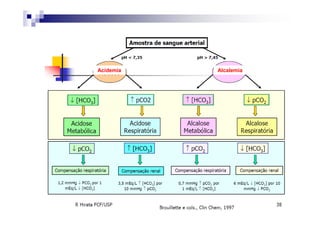
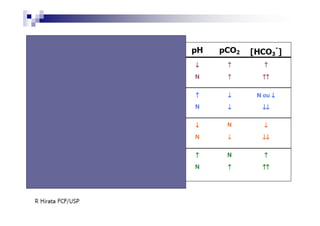
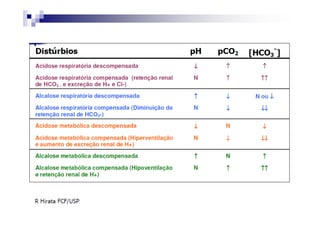
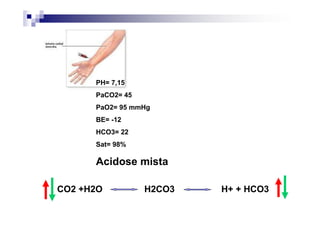
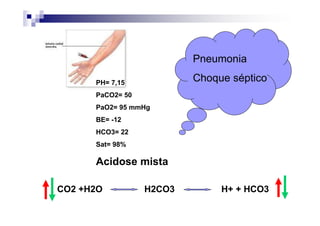
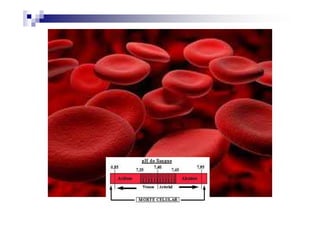
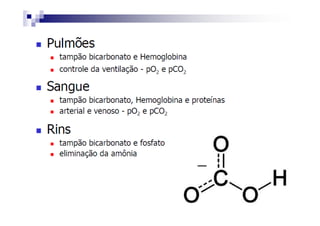
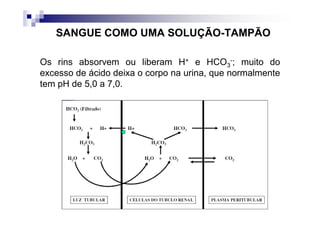
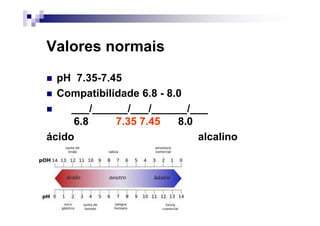
O documento discute distúrbios ácido-básicos. A gasometria fornece informações sobre o pH, eletrólitos, gás carbônico e oxigênio no sangue para diagnosticar tais distúrbios. Um pH abaixo de 7.35 indica acidemia enquanto um pH acima de 7.45 indica alcalemia. É importante analisar o pH, gás carbônico e bicarbonato para determinar se o distúrbio primário é respiratório ou metabólico.




![[H+]](https://image.slidesharecdn.com/distrbioacido-bsico-111031080614-phpapp02/85/Disturbio-acido-basico-6-320.jpg)

![Potencial Hidrogeniônico
A [H+] é quantificada
em unidades de pH](https://image.slidesharecdn.com/distrbioacido-bsico-111031080614-phpapp02/85/Disturbio-acido-basico-9-320.jpg)

![pH = - log [H+]
Solução aquosa neutra 25º C
[H+] = 1 x 10-7
[H+] = 0,000.000.1 M
pH = 7 (neutro)](https://image.slidesharecdn.com/distrbioacido-bsico-111031080614-phpapp02/85/Disturbio-acido-basico-11-320.jpg)


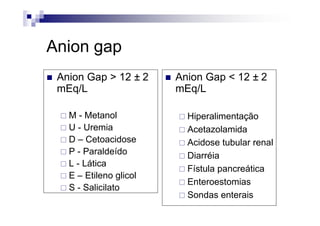
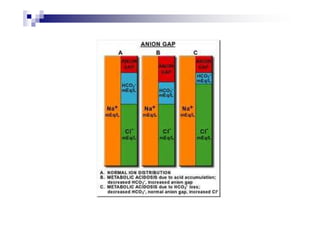
![anion
Anion gap
medida de ânions não mensurados no plasma
valores normais 12 ± 2 mEq/L
Valores > 16 mEq/L
presença de ânions não mensuráveis
A fórmula usada para seu cálculo é:
AG = [(Na+ + K+) – (Cl- + Bicarbonato)]](https://image.slidesharecdn.com/distrbioacido-bsico-111031080614-phpapp02/85/Disturbio-acido-basico-16-320.jpg)
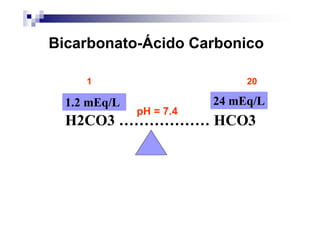
![MÉTODO DE HENDERSON-HASSELBALCH
•utilizada para descrever os distúrbios do equilíbrio
ácido-básico no sangue
parâmetros: pH, PaCO2, bicarbonato, excesso de base
(BE = Base Excess) e anion gap (AG) ou intervalo
aniônico
BE = 0,9287 x [( BIC – 24,4)] + (14,83 x pH – 7,4)]](https://image.slidesharecdn.com/distrbioacido-bsico-111031080614-phpapp02/85/Disturbio-acido-basico-22-320.jpg)

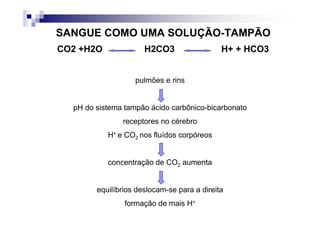
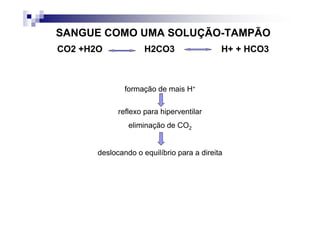










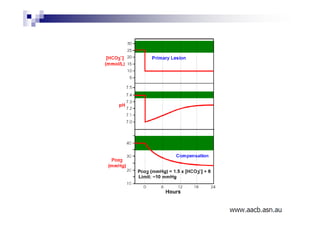
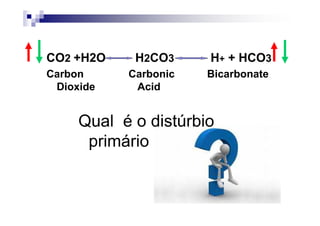
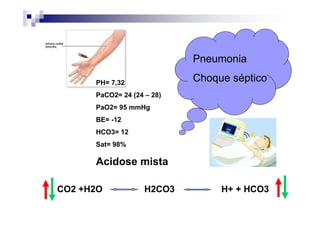
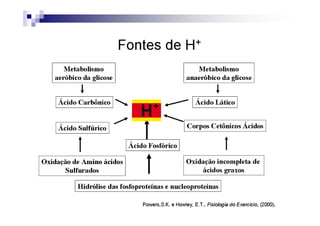
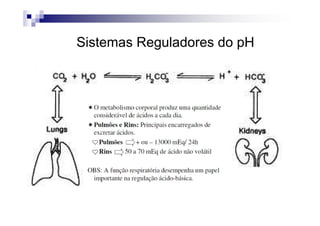
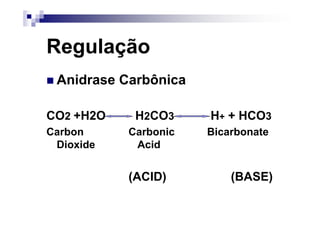
![PaCO2/HCO3
CO2 +H2O H2CO3 H+ + HCO3
Carbon Carbonic Bicarbonate
Dioxide Acid
PaCO2 = [(1,5 x Bic) + 8] +/- 2](https://image.slidesharecdn.com/distrbioacido-bsico-111031080614-phpapp02/85/Disturbio-acido-basico-41-320.jpg)